1.076.523
kiadvánnyal nyújtjuk Magyarország legnagyobb antikvár könyv-kínálatát

VISSZA
A TETEJÉRE
JAVASLATOKÉszre-
vételek
Szervetlen kémia I-II.
Egyetemi tankönyv
| Kiadó: | Nemzeti Tankönyvkiadó |
|---|---|
| Kiadás helye: | Budapest |
| Kiadás éve: | |
| Kötés típusa: | Fűzött kemény papírkötés |
| Oldalszám: | 1.154 oldal |
| Sorozatcím: | |
| Kötetszám: | |
| Nyelv: | Magyar |
| Méret: | 25 cm x 17 cm |
| ISBN: | 963-18-1911-6 |
| Megjegyzés: | Fekete-fehér ábrákkal illusztrálva. |
naponta értesítjük a beérkező friss
kiadványokról
naponta értesítjük a beérkező friss
kiadványokról
Előszó
Az a nagy fejlődés, ami az utolsó fél évszázadban a tudomány valamennyi területén bekövetkezett, a szervetlen kémiát sem hagyta érintetlenül. Hosszú ideig azonban úgy látszott, hogy a periódusos... TovábbElőszó
Az a nagy fejlődés, ami az utolsó fél évszázadban a tudomány valamennyi területén bekövetkezett, a szervetlen kémiát sem hagyta érintetlenül. Hosszú ideig azonban úgy látszott, hogy a periódusos rendszer elemeinek felfedezésével, majd a Bohr-féle atommodell megalkotásával minden olyan alapvető kérdés tisztázódott, ami a szervetlen kémikust érdekelheti. Az volt az általános vélemény, hogy a mikrofizika újabb eredményeit a szervetlen kémiában csupán közvetett úton kell figyelembe venni.A szerves vegyületek szerkezetvizsgálatában az 1930-as évektől kezdve egyre népszerűbbé vált a kvantummechanikai ismereteken alapuló kvantumkémiai szemlélet, aminek alkalmazása termékenyítőleg hatott a szerves kémiai kutatásban, s lehetővé tette a kémiai kötés természetének pontosabb megismerését, megközelítését.
A kvantumkémiai szemlélet a szervetlen kémiában lényegesen lassabban terjedt el. Ennek egyrészt az volt az oka, hogy a szervetlen vegyületek jelentős részét ionosnak tekintették, és a közöttük kialakult kölcsönhatások magyarázatára elegendőnek tartották az elektrosztatikai alaptörvények figyelembevételét. A másik ok az volt, hogy a kvantumkémia gondolatmenetének alkalmazása a szervetlen vegyületek tárgyalására a szerves vegyületekénél bonyolultabbnak látszott.
Az 1940-es évektől kezdve azonban egyre több szervetlen kémikus igyekezett megismerni a kvantumkémia eredményeit, és hasznosítani azokat kutatómunkájában. Ennek következtében megindult e tudományág rohamos fejlődése, s a napjainkban megjelenő tudományos publikációk már kvantumkémiai ismeretekre épülnek. A kifejlesztett újabb anyagszerkezeti vizsgálati módszereket is a kvantumkémiai alaptörvényekből kiindulva fejlesztették ki, így azok ismerete nélkül ezek az eljárások meg sem érthetők.
Az itt vázolt fejlődés számos, a „klasszikus" kémia alapján meg sem oldható kérdésre adott a kísérleti eredményekkel összhangban álló vagy azóta beigazolódott magyarázatot. Ilyen volt pl. a nemesgázhéjak "lezárt"-ságának kérdése, mely a stabilis nemesgázvegyületek felfedezéséhez vezetett; a bór-hidridek szerkezetének magyarázata vagy az ún. hidrogénkötés természetéről alkotott vélemény. De az egyes eseteken túlmenően a kvantumkémiai gondolkodásmód átalakította egész szemléletünket a szervetlen vegyületek szerkezetére, a kémiai kötés lényegére vonatkozóan. Vissza
Tartalom
I. KÖTETElőszó 15
Bevezetés 19
1. Kémiai anyagszerkezet 21
1.1. Az atomelmélet fejlődése 23
1.1.1. Az elektron 29
1.1.2. Az atommag 30
1.1.2.1. A proton és a neutron, az izotópok 33
1.1.2.2. Az atommagok stabilitása 40
1.1.2.3. A természetes radioaktivitás 43
1.1.2.4. Az atommagok mesterséges átalakítása 46
1.1.3. Az elektronhéj 46
1.1.3.1. A kvantumszámok 50
1.1.3.2. Az elektronhéj és az atomok periódusos rendszere 53
1.2. Az atomok elektronhéj-szerkezete 62
1.2.1. A kvantummechanika alapelvei 64
1.2.2. Az „elektron a dobozban" probléma megoldása 66
1.2.3. A hidrogénatom elektronhéjának szerkezete 74
1.2.4. A több elektronos elektronhéjak szerkezete 79
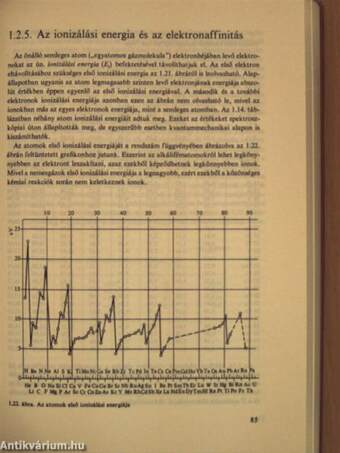
1.2.5. Az ionizálási energia és az elektronaffinitás 85
1.3. A molekulák elektronhéj-szerkezete 88
1.3.1. Molekulaorbitálok leírása az atomorbitálok lineáris kombinációjával (LCAO-MO-módszer) 90
1.3.1.1. Homonukleáris kétatomos molekulák 98
1.3.1.2. Heteronukleáris kétatomos molekulák 102
1.3.1.3. Az elektronegativitás 105
1.3.2. Lokalizálható molekulaorbitálok 109
1.3.2.1. A hibridizáció 111
1.3.2.2. Vegyértékelektronpár-taszítási elmélet 125
1.3.2.3. A koordináció 126
1.3.2.4. Hajlított kötés 127
1.3.2.5. Háromcentrumos kötés 128
1.3.3. Nemlokalizálható molekulaorbitálok 129
1.3.3.1. Delokalizált pí-molekulaorbitálok 130
1.3.3.2. Delokalizált magános párok 135
1.3.3.3. Hidrogénkötés 136
1.3.4. A molekulaszerkezet és a sztöchiometria 138
1.3.4.1. Az oxidációfok 138
1.4. Koordinációs kémia 140
1.4.1. Koordinációs kémiai alapfogalmak 143
1.4.2. A szervetlen vegyületek elnevezésének alapelvei 144
1.4.3. Izoméria, tautoméria 150
1.5. A halmazok szerkezete 152
1.5.1. A nemesgázok szerkezete 155
1.5.2. A nemfémes elemek szerkezete 157
1.5.3. A fémek szerkezete 160
1.5.4. A sók szerkezete 162
1.5.5. Az atomok és az ionok „mérete"; atommagtávolságok 167
1.5.6. A disszociáció és a disszociációfok 171
1.5.7. Az oldatok 174
1.5.7.1. A víz ionszorzata, a pH 177
1.5.7.2. A disszociációs egyensúlyi állandó 179
1.5.7.3. Az oldhatósági szorzat 182
1.5.7.4. Az elektródpotenciál és a redoxipotenciál 183
1.6. A kémiai reakciók 188
1.6.1. A kémiai reakciók szimbolizálása 189
1.6.2. A kémiai reakciók egyensúlya 192
1.6.3. Sav-bázis reakciók 194
1.6.3.1. A savak és bázisok Arrhenius-féle elektrolitos disszociációs elmélete 194
1.6.3.2. A hidrolízis 196
1.6.3.3. A Brönsted- és Lowry-féle sav-bázis elmélet 198
1.6.3.4. Lewis-féle sav-bázis elmélet 200
1.6.4. Redoxireakciók 203
1.6.4.1. Anodikus oxidáció, és katodikus redukció 205
1.6.4.2. A korrózió 206
1.6.5. Katalitikus reakciók 207
2. A kémiai elemek 209
2.1. Általános jellemzés 211
2.1.1. Az izotópok, a nuklidok 212
2.1.2. Az allotrop módosulatok 212
2.1.3. Az atomok gyakorisága és előfordulása 214
2.1.4. Az elemek csoportosítása 215
2.1.5. Az elemek fizikai tulajdonságai 220
2.1.6. Az elemek kémiai tulajdonságai 222
2.1.7. Az elemek előállítása 225
2.1.8. Az elemek gyakorlati alkalmazása 227
2.2. A hidrogén és nuklidjai: prócium (H), deutérium (D), trícium (T) 228
2.2.1. A hidrogén (prócium: H ) 228
2.2.1.1. A hidrogén fizikai és kémiai tulajdonságai 228
2.2.1.2. A hidrogén előfordulása 232
2.2.1.3. A hidrogén előállítása 232
2.2.1.4. A hidrogén felhasználása 233
2.2.1.5. A hidrogén sztereokémiája 234
2.2.1.6. Az orto- és parahidrogén 234
2.2.2. A deutérium (D) 235
2.3. A nemesgázok: hélium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), radon (Ra) 236
2.3.1. A nemesgázok fizikai és kémiai tulajdonságai 236
2.3.2. A nemesgázok előfordulása 238
2.3.3. A nemesgázok előállítása 238
2.3.4. A nemesgázok felhasználása 239
2.3.5. A nemesgázok sztereokémiája 239
2.4. A nemfémek 241
2.4.1. A szén (C) 243
2.4.1.1. A IV. oszlop elemeinek összehasonlítása 243
2.4.1.2. A szén fizikai és kémiai tulajdonságai 245
2.4.1.3. A szén előfordulása 247
2.4.1.4. A szén előállítása 247
2.4.1.5. A szén felhasználása 248
2.5.1.6. A szén sztereokémiája 248
2.4.2. A nitrogén és a foszfor (N, P) 254
2.4.2.1. Az V. oszlop elemeinek összehasonlítása 254
2.4.2.2. A nitrogén és a foszfor fizikai és kémiai tulajdonságai 257
2.4.2.3. A nitrogén és a foszfor előfordulása 258
2.4.2.4. A nitrogén és a foszfor előállítása 258
2.4.2.5. A nitrogén és a foszfor felhasználása 259
2.4.2.6. A nitrogén és a foszfor sztereokémiája 259
2.4.3. Az oxigéncsoport elemei: oxigén (O), kén (S), szelén (Se) 269
2.4.3.1. A VI. oszlop elemeinek összehasonlítása 270
2.4.3.2. Az oxigéncsoport elemeinek fizikai és kémiai tulajdonságai 272
2.4.3.3. Az oxigéncsoport elemeinek előfordulása 272
2.4.3.4. Az oxigéncsoport elemeinek előállítása 273
2.4.3.5. Az oxigéncsoport elemeinek felhasználása 274
2.4.3.6. Az oxigéncsoport elemeinek sztereokémiája 275
2.4.4. A halogének: fluor (F), klór (Cl), bróm (Br), jód (I) 280
2.4.4.1. A VII. oszlop elemeinek összehasonlítása 281
2.4.4.2. A halogének fizikai és kémiai tulajdonságai 283
2.4.4.3. A halogének előfordulása 284
2.4.4.4. A halogének előállítása 285
2.4.4.5. A halogének felhasználása % 285
2.4.4.6. A halogének sztereokémiája 286
2.5. A félfémek 290
2.5.1. A berillium (Be) 291
2.5.1.1. A II. oszlop elemeinek összehasonlítása 291
2.5.1.2. A berillium fizikai és kémiai tulajdonságai 293
2.5.1.3. A berillium előfordulása, előállítása és felhasználása 294
2.5.1.4. A berillium sztereokémiája 295
2.5.2. A bór és az alumínium (B, Al) 296
2.5.2.1. A III. oszlop elemeinek összehasonlítása 297
2.5.2.2. A bór és az alumínium fizikai és kémiai tulajdonságai 297
2.5.2.3. A bór és az alumínium előfordulása 300
2.5.2.4. A bór és az alumínium előállítása 300
2.5.2.5. A bór és alumínium felhasználása 301
2.5.2.6. A bór és az alumínium sztereokémiája 301
2.5.3. A szilícium és a germánium (Si, Ge) 303
2.5.3.1. A szilícium és a germánium fizikai és kémiai tulajdonságai 304
2.5.3.2. A szilícium és a germánium előfordulása, előállítása és felhasználása 304
2.5.3.3. A szilícium és a germánium sztereokémiája 305
2.5.4. Az arzén és az antimon (As, Sb) 308
2.5.4.1. Az arzén és az antimon fizikai és kémiai tulajdonságai 308
2.5.4.2. Az arzén és az antimon előfordulása, előállítása és felhasználása 308
2.5.4.3. Az arzén és az antimon sztereokémiája 309
2.5.5. A tellúr és a polónium (Te, Po) 310
2.5.6. Az asztácium (At) 311
2.6. A másodfajú fémek 312
2.6.1. A rézcsoport: réz (Cu), ezüst (Ag), arany (Au) 313
2.6.1.1. Az 1. oszlop elemeinek összehasonlítása 313
2.6.1.2. A rézcsoport elemeinek fizikai és kémiai tulajdonságai 315
2.6.1.3. A rézcsoport elemeinek előfordulása 316
2.6.1.4. A rézcsoport elemeinek előállítása 317
2.6.1.5. A rézcsoport elemeinek felhasználása 317
2.6.1.6. A rézcsoport elemeinek sztereokémiája 317
2.6.2. A magnézium és a cinkcsoport: magnézium (Mg), cink (Zn), kadmium (Cd),
higany (Hg) 318
2.6.2.1. A magnézium és a cinkcsoport elemeinek fizikai és kémiai tulajdonságai 319
2.6.2.2. A magnézium és a cinkcsoport elemeinek előfordulása 320
2.6.2.3. A magnézium és a cinkcsoport elemeinek előállítása 320
2.6.2.4. A magnézium és a cinkcsoport elemeinek felhasználása 320
2.6.2.5. A magnézium és a cinkcsoport elemeinek sztereokémiája 321
2.6.3. A galliumcsoport: gallium (Ga), indium (In), tallium (TI) 321
2.6.4. Az ón és az ólom (Sn, Pb) 322
2.6.4.1. Az ón és az ólom fizikai és kémiai tulajdonságai 322
2.6.4.2. Az ón és az ólom előfordulása 323
2.6.4.3. Az ón és az ólom előállítása 324
2.6.4.4. Az ón és az ólom felhasználása 324
2.6.4.5. Az ón és az ólom sztereokémiája 325
2.6.5. A bizmut (Bi) 325
2.7. Az átmeneti fémek 327
2.7.1. A szkandiumcsoport: szkandium (Sc), ittrium (Y), lantán (La), aktinium (Ac) 328
2.7.2. A titáncsoport: titán (Ti), cirkónium (Zr), hafnium (Hf) 329
2.7.2.1. A titáncsoport elemeinek fizikai és kémiai tulajdonságai 329
2.7.2.2. A titáncsoport elemeinek előfordulása, előállítása és felhasználása 329
2.7.2.3. A titáncsoport elemcinek vegyületei 330
2.7.3. A vanádiumcsoport: vanádium (V), nióbium (Nb), tantál (Ta) 331
2.7.3.1. A vanádiumcsoport elemeinek fizikai és kémiai tulajdonságai 331
2.7.3.2. A vanádiumcsoport elemeinek előfordulása, előállítása és felhasználása 332
2.7.3.3. A vanádiumcsoport elemeinek vegyületei 332
2.7.4. A krómcsoport: króm (Cr), molibdén (Mo), volfrám (W) 333
2.7.4.1. A krómcsoport elemeinek fizikai és kémiai tulajdonságai 333
2.7.4.2. A krómcsoport elemeinek előfordulása, előállítása és felhasználása 334
2.7.4.3. A krómcsoport elemeinek vegyületei 334
2.7.5. A mangáncsoport: mangán (Mn), technécium (Tc), rénium (Re) 335
2.7.5.1. A mangáncsoport elemeinek fizikai és kémiai tulajdonságai 335
2.7.5.2. A mangáncsoport elemeinek előfordulása, előállítása és felhasználása ... 336
2.7.5.3. A mangáncsoport elemeinek vegyületei 337
2.7.6. A vascsoport: vas (Fe), kobalt (Co), nikkel (Ni) 337
2.7.6.1. A vascsoport elemeinek fizikai és kémiai tulajdonságai 339
2.7.6.2..A vascsoport elemeinek előfordulása, előállítása és felhasználása 340
2.7.6.3. A vascsoport elemeinek vegyületei 342
2.7.7. A platinacsoport: ruténium (Ru), ródium (Rh), palládium (Pd), ozmium (Os), irídium (Ir), platina (Pt) 342
2.7.7.1. A platinafémek fizikai és kémiai tulajdonságai 343
2.7.7.2. A platinafémek előfordulása, előállítása és felhasználása 343
2.7.7.3. A platinafémek vegyületei 344
2.8. A lantanoidák és az aktinoidák 345
2.8.1. A lantanoidák: cérium (Ce), prazeodímium (Pr), neodímium (Nd), prométium (Pm), szamárium (Sm), európium (Eu), gadolínium (Gd), terbium (Tb), diszprózium (Dy), holmium (Ho), erbium (Er), túlium (Tm), itterbium (Yb), lutécium (Lu) 306
2.8.2. Az aktinoidák: tórium (Th), protaktínium (Pa), urán (U), neptúnium (Np), plutónium (Pu), amerícium (Am), kűrium (Cm), berkélium (Bk), kalifornium (Cf), einsteinium (Es), fermium (Fm), mendelévium (Md), nobélium (No), laurencium (Lr) 350
2.9. A fémek 353
2.9.1. Az alkálifémek: lítium (Li), nátrium (Na), kálium (K), rubídium (Rb), cézium (Cs), francium (Fr) 354
2.9.1.1. Az alkálifémek fizikai és kémiai tulajdonságai 354
2.9.1.2. Az alkálifémek előfordulása, előállítása és felhasználása 355
2.9.1.3. Az alkálifémek vegyületei 355
2.9.2. Az alkáliföldfémek: kalcium (Ca), stroncium (Sr),bárium (Ba), rádium (Ra) 356
2.9.2.1. Az alkáliföldfémek fizikai és kémiai tulajdonságai 356
2.9.2.2. Az alkáliföldfémek előfordulása, előállítása és felhasználása 357
2.9.2.3. Az alkáliföldfémek vegyületei 358
3. A vegyületek 359
3.1. A hidridek 363
3.1.1. Kovalens hidridek 365
3.1.1.1. A szén hidridjei 368
3.1.1.2. A nitrogén és a foszfor hidridjei: NH3, N2H4, HN3, PH3, P2H4 375
3.1.1.3. A kalkogének hidridjei: H2O, H2O2, H2S, H2S2, H2S3-5, H2Se 379
3.1.1.4. A halogének hidridjei: HF, HCl, HBr, HI 384
3.1.1.5. A berillium-hidrid: (BeH2)n 388
3.1.1.6. A bór és az alumínium hidridjei: BnHn+4, BnHn+6 (AlH3)n 389
3.1.1.7. A szilícium és a germánium hidridjei: SinH2n+2, GenH2n+2 396
3.1.1.8. Az arzén és az antimon hidridjei: AsH3, SbH3 397
3.1.1.9. A tellúr és a polónium hidridjei: H2Te, H2Po 398
3.1.1.10. A másodfajú fémek hidridjei 398
3.1.2. Sószerű hidridek 398
3.1.2.1. Az alkálifémek hidridjei: LiH, NaH, KH, RbH, CsH 399
3.1.2.2. Az alkáliföldfémek hidridjei: CaH2, SrH2, BaH2 400
3.1.3. Interszticiális hidridek 401
3.1.4. Komplex hidridek 403
3.1.4.1. Borohidridek 403
3.1.4.2. Aluminohidridek 404
3.2. A halogenidek: fluoridok, kloridok, bromidok, jodidok 406
3.2.1. Egyszerű halogenidek 408
3.2.1.1. Biner halogenidek 408
3.2.1.2. A hidridek halogénszármazékai és a vegyes halogenidek 413
3.2.2. Összetett halogenidek 414
3.2.2.1. Kettős halogenidek 414
3.2.2.2. Halogenokomplexek 414
3.2.3. A nemesgázok halogenidjei 418
3.2.4. A nemfémek halogenidjei 419
3.2.4.1. A szén halogenidjei 419
3.2.4.2. A nitrogén és a foszfor halogenidjei 422
3.2.4.3. Az oxigéncsoport elemeinek halogenidjei 423
3.2.4.4. A halogének halogenidjei (interhafogének) 424
3.2.5. A félfémek halogenidjei ! 427
3.2.5.1. A berillium halogenidjei 427
3.2.5.2. A bór és az alumínium halogenidjei 428
3.2.5.3. A szilícium és a germánium halogenidjei 431
3.2.5.4. Az arzén és az antimon halogenidjei 433
3.2.5.5. A tellúr és a polónium halogenidjei 435
3.2.6. A másodfajú fémek halogenidjei 436
3.2.6.1. A rézcsoport elemeinek halogenidjei 437
3.2.6.2. A magnézium és a cinkcsoport elemeinek halogenidjei 440
3.2.6.3. A galliumcsoport elemeinek halogenidjei 441
3.2.6.4. Az ón és az ólom halogenidjei 443
3.2.6.5. A bizmut halogenidjei 444
3.2.7. Az átmeneti fémek halogenidjei 445
3.2.7.1. A szkandiumcsoport elemeinek halogenidjei 445
3.2.7.2. A titáncsoport elemeinek halogenidjei 445
3.2.7.3. A vanádiumcsoport elemeinek halogenidjei 447
3.2.7.4. A krómcsoport elemeinek halogenidjei 450
3.2.7.5. A mangáncsoport elemeinek halogenidjei 452
3.2.7.6. A vascsoport elemeinek halogenidjei 454
3.2.7.7. A platinafémek halogenidjei 455
3.2.8. A lantanoidák és az aktinoidák halogenidjei 457
3.2.9. A fémek halogenidjei 458
3.2.9.1. Az alkálifémek halogenidjei 458
3.2.9.2. Az alkálifoldfémek halogenidjei 458
3.3. Az oxidok 460
3.3.1. Egyszerű oxidok 462
3.3.1.1. Biner oxidok 462
3.3.1.2. Peroxidok és szuperoxidok 465
3.3.1.3. Halogenid-oxidok 468
3.3.2. Összetett oxidok 469
3.3.2.1. Bázisok és hidroxidok 469
3.3.2.2. Oxosavak 471
3.3.2.3. Oxoanionokat tartalmazó vegyületek 475
3.3.2.4. Oxokationokat tartalmazó vegyületek 483
3.3.2.5. Kettős oxidok 483
3.3.3. A nemesgázok oxidjai 484
3.3.4. A nemfémek oxidjai 484
3.3.4.1. A szén oxidjai és összetett oxidjai 485
3.3.4.2. A nitrogén és a foszfor oxidjai és összetett oxidjai 487
3.3.4.3. A kén és a szelén oxidjai és összetett oxidjai 489
3.3.4.4. A halogének oxidjai és összetett oxidjai 493
3.3.5. A félfémek oxidjai 496
3.3.5.1. A berillium oxidjai és összetett oxidjai 496
3.3.5.2. A bór és az alumínium oxidjai és összetelt oxidjai 496
3.3.5.3. A szilícium és a germánium oxidjai és összetett oxidjai 497
3.3.5.4. Az arzén és az antimon oxidjai és összetett oxidjai 498
3.3.5.5. A tellúr és a polónium oxidjai és összetett oxidjai 499
3.3.6. A másodfajú fémek oxidjai 500
3.3.6.1. A rézcsoport elemeinek oxidjai és összetett oxidjai 500
3.3.6.2. A magnézium és a cinkcsoport elemeinek oxidjai és összetett oxidjai 500
3.3.6.3. A galliumcsoport elemeinek oxidjai és összetett oxidjai 501
3.3.6.4. Az ón és az ólom oxidjai és összetett oxidjai 501
3.3.6.5. A bizmut oxidjai és összetett oxidjai 502
3.3.7. Az átmeneti fémek oxidjai 502
3.3.7.1. A szkandiumcsoport elemeinek oxidjai és összetett oxidjai 503
3.3.7.2. A titáncsoport elemeinek oxidjai és összetett oxidjai 503
3.3.7.3. A vanádiumcsoport elemeinek oxidjai és összetett oxidjai 503
3.3.7.4. A krómcsoport elemeinek oxidjai és összetett oxidjai 504
3.3.7.5. A mangáncsoport elemeinek oxidjai és összetett oxidjai 505
3.3.7.6. A vascsoport elemeinek oxidjai és összetett oxidjai 507
3.3.7.7. A platinacsoport elemeinek oxidjai és összetett oxidjai 507
3.3.8. A lantanoidák és aktinoidák oxidjai 508
3.3.8.1. A lantanoidák oxidjai és összetett oxidjai 508
3.3.8.2. Az aktinoidák oxidjai és összetett oxidjai 508
3.3.9. A fémek oxidjai 509
3.3.9.1. Az alkálifémek oxidjai és összetett oxidjai 509
3.3.9.2. Az alkáliföldfémek oxidjai és összetett oxidjai 509
3.4. A szulfidok 510
3.4.1. Egyszerű szulfidok 512
3.4.1.1. Biner szulfidok 512
3.4.1.2. Poliszulfidok és diszulfidok 514
3.4.1.3. Tio-halogenidek 515
3.4.1.4. Oxid-szulfidok 515
3.4.2. Összetett szulfidok 515
3.4.2.1. Tiosavak 516
3.4.2.2. Tiobázisok 516
3.4.2.3. Tioanionokat tartalmazó vegyületek 516
3.4.2.4. Kettős szulfidok 517
3.4.3. A nemfémek szulfidjai 518
3.4.4. A félfémek szulfidjai 519
3.4.5. A másodfajú fémek szulfidjai 520
3.4.6. Az átmeneti fémek szulfidjai 521
3.4.7. A lantanoidák és az aktinoidák szulfidjai 521
3.4.8. A fémek szulfidjai 522
3.5. A nitridek és a foszfidok 523
3.5.1. A nemfémek nitridjei 523
3.5.1.1. A szén nitridjei 524
3.5.1.2. A foszfor nitridjei 529
3.5.1.3. A kén nitridjei 531
3.5.2. A félfémek nitridjei és foszfidjai 532
3.5.3. A másodfajú fémek nitridjei és foszfidjai 533
3.5.4. Az átmeneti fémek nitridjei és foszfidjai 534
3.5.5. A lantanoidák és az aktinoidák nitridjei és foszfidjai 535
3.5.6. A fémek nitridjei és foszfidjai 535
3.6. Karbidok, cianidok, karbonilok 537
3.6.1. A karbidok 537
3.6.1.1. Kovalens karbidok 537
3.6.1.2. Sószerű karbidok 539
3.6.1.3. Az interszticiális karbidok 542
3.6.2. A cianidok 543
3.6.2.1. Egyszerű cianidok 543
3.6.2.2. Cianokomplexek 546
3.6.3. A karbonilok 547
Ajánlott irodalom 550
Név- és tárgymutató 551
II. KÖTET
1. Kémiai kötés és molekulaszerkezet
1.1. A kvantummechanika alapjai 15
1.1.1. A korpuszkula-hullám dualizmus értelmezése 15
1.1.2. A bizonytalansági elv 17
1.1.3. Kvantummechanika és kísérleti észlelés 20
1.1.4. A hullámfüggvények 21
1.1.5. A Schrödinger-egyenlet 23
1.2. A kvantummechanika alkalmazásának lehetőségei 26
1.2.1. Az elektron állapota és energiája potenciálmentes térben 26
1.2.2. A harmonikus oszcillátor kvantummechanikai modellje 29
1.2.3. A merev rotátor kvantummechanikai modellje 31
1.3. A hidrogénatom kvantummechanikai leírása 36
1.3.1. Sajátfüggvények és energia-sajátértékek 36
1.3.2. A hidrogénatom sajátfüggvényeinek geometriai ábrázolása 41
1.3.2.1. A hullámfüggvény szögtől függő komponensének ábrázolása 42
1.3.2.2. A hullámfüggvény sugártól függő összetevőjének vizsgálata 44
1.3.2.3. A sajátfüggvények szintvonal-diagramja 47
1.3.3. A hidrogénatom spektruma 48
1.3.4. Az elektronspin 50
1.4. Több elektronos atomok 54
1.4.1. Az elektronhéj lehetséges állapotai 54
1.4.2. A független részecske modell (központi erőtér modell) 56
1.4.2.1. Egyelektronos állapotok 56
1.4.2.2. A több elektronos atomok elektronhéj-konfigurációja 59
1.4.2.3. Több elektronos atomok több vegyértékelektronnal 61
1.4.2.4. A termek és konfigurációk felhasadása 67
1.5. A molekulák és sajátságaik 70
1.5.1. A molekula definíciója 70
1.5.2. A molekula képződéssel járó energiaváltozások jellege és nagysága 72
1.5.3. A molekulák geometriája és szimmetriája 75
1.5.3.1. Kötéstávolságok és kötésszögek 75
1.5.3.2. Kémiai képlet és a molekulák szerkezete, izoméria 80
1.5.3.3. Mozgóvázú (flexibilis) molekulák, permutációs izoméria 83
1.5.3.4. A molekulák szimmetriája 85
1.5.4. A molekulák dipólusmomentuma 90
1.5.4.1. A molekulák permanens dipólusmomentuma 91
1.5.4.2. A molekulák polarizálhatósága 92
1.5.4.3. A dielektromos állandó (relatív permittivitás) és a törésmutató 93
1.5.4.4. Az optikai aktivitás 95
1.5.5. A mágneses momentum 96
1.5.5.1. A permanens és az indukált mágneses momentum 96
1.5.5.2. A mágneses szuszceptibilitás 97
1.5.6. A molekulák gerjesztett állapotai 98
1.6. A kémiai kötés nem kvantummechanikai tárgyalása 101
1.6.1. Történeti áttekintés 101
1.6.2. Kötéstípusok 103
1.6.3. A kovalens kötés kétatomos molekulákban 105
1.6.3.1. A vegyérték-formalizmus 105
1.6.3.2. A kémiai kötés poláris jellege, az elektronegativitás 108
1.6.4. A több atomos molekulákban kialakuló kovalens kötések 111
1.6.4.1. A kémiai kötés és a molekulák tulajdonságai 114
1.6.5. A vegyértékhéj-elektronpár taszítási modell (VSEPR) 118
1.7. A kémiai kötés kvantummechanikai modellje 125
1.7.1. A Born-Oppenheimer-közelítés 126
1.7.2. Különböző kvantummechanikai elméletek 129
1.7.2.1. A molekulaorbitál- (MO-) elmélet 129
1.7.2.2. A VB- (valence bond) elmélet 130
1.8. Az MO-elmélet 133
1.8.1. Az MO-elmélet alkalmazása kétatomos molekulákra 133
1.8.1.1. Az átfedés jelentősége a kémiai kötés kialakulása szempontjából 139
1.8.1.2. A kétatomos, homonukleáris molekulák 141
1.8.1.3. A kétatomos, homonukleáris molekulák elektronállapotainak osztályozása 146
1.8.1.4. A kétatomos, heteronukleáris molekulák 149
1.8.2. Az MO-elmélet alkalmazása több atomos molekulákra 152
1.8.2.1. Háromatomos molekulák 152
1.8.2.2. Összetett molekulák 156
1.8.3. Egyenértékű orbitálok kialakulása a több atomos molekulákban 159
1.8.3.1. Delokalizált és lokalizált molekulaorbitálok 159
1.8.3.2. A hibridorbitálok 161
1.8.4. A több atomos molekulák lehetséges kötésmodelljei 164
1.8.4.1. A kétcentrumos-kételektronos kötések 164
1.8.4.2. A háromcentrumos kötések 168
1.8.4.3. Sokcentrumos kötések kialakulása 170
1.9. A ligandumtér-elmélet 173
1.9.1. A modell és korlátai 173
1.9.2. Átmenetifém-ionok több d-elektronnal oktaéderes ligandumtérben 179
1.9.3. A Jahn-Teller-hatás 183
1.10. A koordinációs vegyületek MO-elméletének alapjai 186
1.10.1. Komplexek fém-ligandum -kötéssel 187
1.10.2. Komplexek fém-ligandum -kötéssel 189
2. Koordinációs kémia
2.1. Történeti áttekintés, a koordinációs vegyület definíciója 195
2.2. Fématomok, fémionok 200
2.2.1. Az átmenetifém-kationok 202
2.2.1.1. Az átmenetifémek helye a periódusos rendszerben 203
2.2.1.2. Az atomok és az ionok elektronhéj-konfigurációja 205
2.2.1.3. A mágneses tulajdonságok szerepe az átmenetifémek koordinációs kémiájában 206
2.3. Ligandumok 211
2.4. A koordinációs szám és a komplexek geometriája 218
2.4.1. A kettes koordinációs szám 219
2.4.2. A hármas koordinációs szám 219
2.4.3. A négyes koordinációs szám 220
2.4.3.1. Tetraéderes komplexek 220
2.4.3.2. Síknégyzetes komplexek 221
2.4.4. Az ötös koordinációs szám 221
2.4.5. A hatos koordinációs szám 223
2.4.6. A hetes koordinációs szám 224
2.4.7. A nyolcas koordinációs szám 224
2.4.8. A kilences koordinációs szám 226
2.5. A koordinációs vegyületek izomériája 227
2.5.1. Cisz-transz izoméria 227
2.5.2. Optikai izoméria 229
2.5.3. Az izomerek szerkezetének meghatározása 231
2.6. Komplex egyensúlyok, a komplexek stabilitása 234
2.6.1. A komplex egyensúlyok fajtái 234
2.6.1.1. Komplexképződés egyfogú, semleges ligandummal 234
2.6.1.2. Komplexképződés egyfogú, anionos ligandummal 235
2.6.1.3. Komplexképződés több fogú ligandummal 237
2.6.1.4. Több magvú komplexek képződése 238
2.6.1.5. Vegyesligandum komplexek képződése 239
2.6.1.6. Komplexképződés a belső, illetve külső szférában 240
2.6.2. A komplexstabilitási állandók 240
2.6.2.1. Komplexek összetételének és stabilitási állandójának meghatározása 243
2.6.3. A komplexképződés termodinamikája 245
2.6.4. A komplexek stabilitásának változása a központi atom és a ligandum minőségének függvényében 247
2.6.5. összefüggés a lépcsőzetes komplexképződés és a komplexek stabilitása között 251
2.6.6. Komplexképződési és más reakciók egyidejű lejátszódása 254
2.7. Fém-ligandum kovalens kötést tartalmazó koordinációs vegyületek 258
2.7.1. -donor- -akceptor ligandumokkal képzett komplexek 258
2.7.1.1. A fém-karbonilok 261
2.7.1.2. Cianid- és izocianidkomplexek 271
2.7.1.3. Dinitrogénkomplexek 276
2.7.1.4. Nitrogén-monoxid-komplexek 278
2.7.1.5. Az V. és VI. főcsoport további elemeit donoratomokként tartalmazó ligandumok koordinációs vegyületei 280
2.7.2. -donor- -akceptor ligandumokkal képzett koordinációs vegyületek 283
2.7.2.1. Olefinkomplexek 285
2.7.2.2. Ciklopentadienil-komplexek v 288
2.7.2.3. Egyéb aromás fémkomplexek 291
2.8. A koordinációs vegyületek reakciói 294
2.8.1. Komplexek fém-ligandum elektrosztatikus kölcsönhatással 296
2.8.1.1. Fémionok fém-ligandum kötés kialakulásával járó reakciói 296
2.8.1.2. A központi atom-ligandum kötés felhasadásával járó reakciók 299
2.8.1.3. A D-Y kötés reakciói 306
2.8.1.4. A ligandum egyéb csoportjainak (Y) reakciói 308
2.8.2. A -akceptor ligandumokkal képzett komplexek reakciói 308
2.8.2.1. A fém-karbonilok reakciói 309
2.9. Koordinációs vegyületek segítségével lejátszódó katalitikus reakciók 312
2.9.1. Homogén katalízis 312
2.9.1.1. Olefinek polimerizációja 313
2.9.1.2. Olefinek oxidációja palládiumkomplexek segítségével 315
2.9.1.3. Olefinek hidrogénezése és hidroformilezése 317
2.9.1.4. A koordinációs vegyületek katalizálta reakciók általános modellje 318
3. Elemorganikus kémia
3.1. Az elemorganikus vegyületek általános jellemzése 323
3.2. Az elemorganikus vegyületek csoportosítása az elem-szén kötés típusa szerint 325
3.2.1. Kovalens, kételektronos kötések 325
3.2.2. Ionkötést tartalmazó elemorganikus vegyületek 328
3.2.3. Az elektronhiányos elem-szén kötés 328
3.3. Az elemorganikus vegyületek stabilitása 329
3.3.1. A termodinamikai stabilitás 329
3.3.2. Az oxidációval szemben mutatott stabilitás 331
3.3.3. A hidrolízissel szemben mutatott stabilitás 331
3.4. Lehetőségek az elem-szén kötés kialakítására 332
3.4.1. Szerves halogenidek és főcsoportbeli elemek reakciója 332
3.4.2. Elem-szén kötés kialakítása elemcsere útján 335
3.4.3. Elemorganikus vegyületek reakciója fém-halogenidekkel 336
3.4.4. Olefinek és acetilének elem-hidrogén kötésbe való beékelődése 338
3.4.5. Elem-szén kötés kialakítása egyéb beékelődési reakciók révén 340
3.4.6. Diazovegyületek elem-szén kötés kialakulásával járó reakciói 341
3.4.7. Nagyobb rendszámú elemek sóinak dekarboxilezése 342
3.4.8. Szerves vegyületek merkurálása és talliumozása 343
3.5. Poláris elem-szén kötést tartalmazó elemorganikus vegyületek 345
3.5.1. A vegyületek általános jellemzése 346
3.5.2. A poláris elem-szén kötést tartalmazó fém-alkilok szerkezete 349
3.5.3. Preparatív módszerek 355
3.5.3.1. Lítiumvegyületek előállítása 355
3.5.3.2. Nátriumvegyületek előállítása 358
3.5.3.3. Magnéziumvegyületek előállítása 361
3.5.3.4. Berilliumvegyületek előállítása 365
3.5.3.5. A cink, kadmium és higany vegyületeinek előállítása 367
3.5.3.6. Bórvegyületek előállítása 371
3.5.3.7. Alumíniumvegyületek előállítása 389
3.5.3.8. Gallium-, indium- és talliumvegyületek előállítása 394
3.6. Kis polaritású elem-szén kötést tartalmazó elemorganikus vegyületek 396
3.6.1. A IV. főcsoport elemeinek elemorganikus vegyületei 397
3.6.1.1. A vegyületek stabilitása és reakcióképessége 397
3.6.1.2. A IV. főcsoport elemeinek paraffin-szénhidrogénekkel analóg elemorganikus vegyületei 398
3.6.1.3. A vegyületek koordinációs száma 400
3.6.1.4. Lehetőség -kötések kialakítására 402
3.6.1.5. Preparatív módszerek a csoport elemorganikus vegyületeinek előállítására 405
3.6.1.6. Alapvető reakciótípusok 407
3.6.1.7. Szilikonok 409
3.6.2. Az V. főcsoport elemeinek elemorganikus vegyületei 414
3.6.2.1. Az elemorganikus származékok donor-akceptor sajátsága 416
3.6.2.2. A foszfinok 417
3.6.2.3. Óniumvegyületek 418
3.6.2.4. Pentaalkilok és -arilok 419
3.6.2.5. Elem-elem kötést tartalmazó láncszerű és gyűrűs vegyületek 420
3.6.2.6. Reakciótípusok 422
3.7. Átmenetifém-szén -kötést tartalmazó vegyületek 425
4. Környezeti kémia
4.1. A környezet evolúciója 431
4.1.1. Az elemek és a csillagközi molekulák képződése 431
4.1.1.1. Az elemek szintézise 431
4.1.1.2. Atomok és molekulák a csillagközi térben 435
4.1.2. A Föld kialakulása és fejlődése 439
4.1.2.1. A Föld kialakulásának hipotézise 439
4.1.2.2. Az elemek elsődleges differenciálódása 441
4.1.2.3. Az elemek másodlagos differenciálódása 445
4.1.2.4. Az elemek ércekben való koncentrálódása 447
4.1.3. A kémiai evolúció 449
4.1.3.1. A primitív Föld atmoszférája és hidroszférája, a biológiailag fontos vegyületek szintézise 450
4.1.3.2. A biopolimerek kialakulása 456
4.1.3.3. Az élő sejtek megjelenése 460
4.1.4. Az atmoszféra kialakulásának második lépcsője 461
4.1.5. Az atmoszféra kialakulásának harmadik lépcsője 463
4.2. A bioszféra szempontjából fontos elemek környezeti kémiája 465
4.2.1. A szén körforgása 466
4.2.2. Az oxigén körforgása 471
4.2.3. A nitrogén körforgása 473
4.2.4. A kén körforgása 477
4.2.5. A foszfor körforgása 480
4.2.6. Biológiai szempontból fontos fémek és nyomelemek környezeti kémiája.. 482
4.2.6.1. A vas 484
4.2.6.2. A króm 486
4.2.6.3. A mangán 486
4.2.6.4. A réz 487
4.2.6.5. A berillium, magnézium, kalcium, stroncium és bárium 487
4.2.6.6. A cink, kadmium és higany 488
4.2.6.7. A bór 490
4.2.6.8. Az ón és az ólom 491
4.2.6.9. Az arzén 492
4.2.6.10. A szelén 492
4.2.6.11. A halogének 493
4.2.6.12. A pE fogalma, az elemek adott oxidációfokú állapotának stabilitása a természetben 494
4.2.7. A természetben lejátszódó komplexképződés 497
4.3. A hidroszféra kémiája 501
4.3.1. A víz kémiája 501
4.3.1.1. A vízmolekula 501
4.3.1.2. A víz mint oldószer 503
4.3.1.3. A víz sajátságai 504
4.3.1.4. A víz reakciói 505
4.3.2. A hidroszféra 506
4.3.2.1. A víz körforgása, a természetes vizek összetétele, sav-bázis egyensúlyok a hidroszférában 507
4.3.2.2. A Sillén-féle óceánmodell 512
4.3.2.3. A természetes édesvizek öntisztulása 515
4.3.3. Az élővizek szennyezése antropogén emisszió révén 516
4.3.3.1. A szennyezőanyagok főbb típusai 516
4.3.3.2. Oxigént fogyasztó szennyezések 517
4.3.3.3. Mérgező vízszennyezések 519
4.3.4. Vízkezelés 523
4.4. Az atmoszféra kémiája 526
4.4.1. Az atmoszféra összetétele és tulajdonságai 526
4.4.2. Az atmoszféra kiterjedése, hőmérsékletének és nyomárának változása 529
4.4.3. Hőmérséklet-inverzió 533
4.4.4. Az atmoszférában lejátszódó fotokémiai folyamatok 535
4.4.4.1. Fotokémiai reakciók az atmoszféra felső rétegében 535
4.4.4.2. Az ózon fotokémiai képződése és reakciói az atmoszférában 539
4.4.4.3. A vízmolekula fotokémiai reakciói 540
4.4.4.4. A nitrogénmolekula fotokémiai reakciói 541
4.4.5. Az atmoszféra alsóbb rétegeiben lejátszódó fotokémiai folyamatok, a fotokémiai füstköd 542
4.4.5.1. A nitrogén-oxidok reakciói szénhidrogének távollétében 544
4.4.5.2. Fotokémiai reakciók a városi atmoszférában 548
4.4.5.3. Lehetőségek a fotokémiai füstköd kialakulásának megakadályozására 553
4.4.5.4. A kén-dioxid fotokémiai reakciói az atmoszférában 554
4.4.5.5. A klór-fluor-szénhidrogének reakciói az atmoszférában 555
Témakörök
- Műszaki > Ipar > Nehézipar > Vegyipar
- Természettudomány > Kémia > Szervetlen kémia
- Természettudomány > Kémia > Tankönyvek > Felsőoktatási
- Természettudomány > Kémia > Vegyészet, vegyipar
- Műszaki
- Műszaki > Tankönyvek, jegyzetek, szöveggyűjtemények > Felsőoktatási
- Tankönyvek, jegyzetek, szöveggyűjtemények > Műszaki > Felsőoktatási > Nehézipari
- Tankönyvek, jegyzetek, szöveggyűjtemények > Természettudományok > Kémia > Felsőoktatási
Megvásárolható példányok
Nincs megvásárolható példány
A könyv összes megrendelhető példánya elfogyott. Ha kívánja, előjegyezheti a könyvet, és amint a könyv egy újabb példánya elérhető lesz, értesítjük.