1.067.053
kiadvánnyal nyújtjuk Magyarország legnagyobb antikvár könyv-kínálatát

VISSZA
A TETEJÉRE
JAVASLATOKÉszre-
vételek
Fizikai kémia I.
A termodinamika főtételei. A halmazállapotok. Az oldatok törvényei. Heterogén rendszerek egyensúlyi viszonyai. Kémiai mechanika. A kémiai egyensúlyok termodinamikája. Elektrokémia. Határfelületi jelenségek és kolloid oldatok
| Kiadó: | Királyi Magyar Egyetemi Nyomda |
|---|---|
| Kiadás helye: | Budapest |
| Kiadás éve: | |
| Kötés típusa: | Könyvkötői vászonkötés |
| Oldalszám: | 605 oldal |
| Sorozatcím: | |
| Kötetszám: | |
| Nyelv: | Magyar |
| Méret: | 23 cm x 16 cm |
| ISBN: | |
| Megjegyzés: | 143 fekete-fehér ábrával illusztrált. Nyomtatta a Királyi Magyar Egyetemi Nyomda, Budapest. Gróh Gyula egyetemi ny. r. tanár közreműködésével írta Erdey-Grúz Tibor egyetemi m. tanár, Náray-Szabó István egyetemi ny. rk. tanár és Schay Géza egyetemi ny. rk. tanár. |
naponta értesítjük a beérkező friss
kiadványokról
naponta értesítjük a beérkező friss
kiadványokról
Előszó
E könyv alapjainak lerakását ezelőtt több mint 15 évvel indítottam meg, midőn - mint a Pázmány Péter Tudományegyetem magántanára - a fizikai kémia egynémely fejezetét kezdtem előadni. Így készült... TovábbElőszó
E könyv alapjainak lerakását ezelőtt több mint 15 évvel indítottam meg, midőn - mint a Pázmány Péter Tudományegyetem magántanára - a fizikai kémia egynémely fejezetét kezdtem előadni. Így készült el, mint részletesen kidolgozott előadási jegyzet, a halmazállapotokról, az oldatokról, a fázisszabályról, a kémiai mechanikáról, továbbá a kolloid rendszerekről szóló fejezet. A munka többirányú elfoglaltságom miatt lassan haladt. Gyorsítására az adta meg az impulzust, hogy negyedfélévvel ezelőtt ugyancsak a Pázmány Péter Tudományegyetem ny. r. tanárává neveztetvén ki, a fizikai kémia tanítása szorosabb értelemben vett hivatásommá lett.Ekkor éreztem fokozott szükségét annak, hogy hallgatóink kezébe megfelelő tankönyvet adjunk, ha azt a célt akarjuk szolgálni, hogy ebben a tudományágban, mely a fejlődés mai fokán centrális helyet foglal el a kémiai tudományok között, az elemi ismereteken túlmenő, rendszeres tudásra tegyenek szert. A fizikai kémia rendkívüli fejlődése az utóbbi évtizedekben az anyagnak olyan terjedelmét eredményezte, hogy ennek a kívánatos mértékben való közlése túllépni az egyszerű egyetemi előadás kereteit. Ezért van szükség olyan tankönyvre, amelyből a hallgatóság a nagy vonásokra szorítkozó előadást csekély fáradsággal maga is kiegészítheti. Ilyen tankönyv eddig nemcsak magyar nyelven nem állt rendelkezésre, hanem a kevésszámú modern idegennyelvű tankönyv is vagy túl rövid, vagy pedig túl terjedelmes, illetőleg túl nagy előképzettséget tételez fel. Vissza
Tartalom
BEVEZETÉSA termodinamika I. és II. főtétele
1. §. Bevezetés 1
2. §. A termodinamika I. főtétele (Az energia megmaradásának elve) 2
3. §. Izoterm folyamatokkal egybekötött energiaváltozások hőmérsékleti koefficiense (Kirchhoff tétele) 6
4. §. Ideális gázok állapotegyenlete 9
5. §. Ideális gázok izoterm kiterjedésekor termelhető legnagyobb munka 13
6. §. A termodinamika II. főtétele 16
7. §. A termodinamikai egyensúly feltételei izoterm rendszerekben 21
8. §. A maximális munka hőmérsékleti koefficiense. A hőtranszport útján termelhető maximális munka 27
9. §. A két főtétel egyesítése: Gibbs és Helmholtz egyenletei 33
10. §. A szabad energia, a termodinamikus potenciál és az entrópiafüggvény 34
I. FEJEZET
A gáz-halmazállapot
11. §. A gáz-halmazállapot. Ideális és reális gázok 39
12. §. Eltérések a gáztörvényektől 40
13. §. van der Waals egyenlete 44
14. §. Kinetikus gázelmélet 47
15. §. A molekulák szabad úthossza. Az ütközések száma 50
16. §. Avogadro tétele, az Avogadro-Loschmidt-féle szám 52
17. §. A gázok fajhője (molekulahője) 54
18. §. Adiabatikus állapotváltozások 61
19. §. A Joule-Thomson-féle hatás 64
20. §. Boltzmann tétele. A Marxwell-féle sebességeloszlás 67
21. §. A Boltzmann-tétel alkalmazása diszkrét energia-értékekre: a kvantumelmélet elemei. A gázok molekulahőjének függése a hőmérséklettől 73
22. §. A kinetikus gázelmélet és a termodinamika II. főtétele 76
23. §. Entrópia és valószínűség. A termodinamika statisztikus értelmezése 80
Számpéldák 1-13. 82
II. FEJEZET
A folyékony halmazállapot
24. §. A folyékony halmazállapot általános jellemzése 84
25. §. A folyadékmolekulákra ható erők 88
26. §. A folyadék és gőz egyesített van der Waals-féle egyenlete 93
27. §. A kritikus jelenségek és a van der Waals-egyenlet 97
28. §. A redukált állapotegyenlet. A megfelelő állapotok tétele 100
29. §. A párolgási hő 103
30. §. A tenziógörbe 106
31. §. A Clausius-Claperyon-féle egyenlet 109
32. §. A tenziógörbe kinetikus értelmezése 114
33. §. A forráspont 116
34. §. Felületi energia. A folyadékok felületi feszültsége 121
35. §. A felületi feszültséggel összefüggő jelenségek 124
36. §. Tiszta folyadékok felületi feszültsége és annak a hőmérséklettől való függése. Eötvös szabálya 128
III. FEJEZET
A szilárd halmazállapot
37. §. A szilárd halmazállapot általános jellemzése 135
38. §. A geometriai krisztallográfia elemei 137
39. §. A kristályok mint térrácsok 147
40. §. A kristályrácsokban működő erők 154
41. §. A szilárd testek fajhője; Dulong-Petit és Neumann-Korr szabálya 157
42. §. A szilárd testek fajhőjének változása a hőmérséklettel 159
43. §. Az egyszerű szilárd testek jellemző frekvenciái 164
44. §. A szilárd testek átalakulásai és ezek latens hői 167
45. §. Az olvadáspont és átalakulási pontok változása a külső nyomással 171
46. §. A szilárd testek párolgása (szublimálás) 172
47. §. Halmazállapotok és módosulatok egyensúlyai; hármaspontok 176
IV. FEJEZET
Az oldatok törvényei
48. §. Az elegyekről és az oldatokról általában 183
49. §. Az oldatok összetételének (koncentrációjának) mértékegységei 185
50. §. Gázelegyek 187
51. §. Az oldatok tenziója (gőznyomása) 188
52. §. Az ideális oldatok 193
53. §. Az ozmózisnyomás 195
54. §. A híg oldatok tenziócsökkenése 198
55. §. A híg oldatok forráspontemelkedése 200
56. §. A híg oldatok fagyáspontcsökkenése 201
57. §. Híg oldatok ozmózisnyomása; az ozmózisos munka 204
58. §. Az oldott anyagok diffúziója 208
59. §. Gázok oldhatósága folyadékokban: Henry törvénye 213
60. §. Folyadékok oldhatósága egymásban 215
61. §. Eltérések az ideális viselkedéstől 217
62. §. Szilárd testek oldhatósága folyadékokban 219
63. §. Oldott anyagok megoszlása két oldószer között 222
64. §. Illékony folyadékok elegyének párolgása és desztillálása 224
Számpéldák 14-27. 229
V. FEJEZET
Heterogén rendszerek egyensúlyi viszonyai (Fázis-szabály)
65. §. Bevezetés. A Gibbs-féle fázis-szabály 231
66. §. A fázis-szabály bizonyítása 235
A) Egykomponensű rendszerek
67. §. Enantiotrópia és monotrópia 236
B) Kétkomponensű (binér) rendszerek
68. §. A kétkomponensű rendszerekről általában 239
69. §. Szilárd testek oldékonysága folyadékokban 239
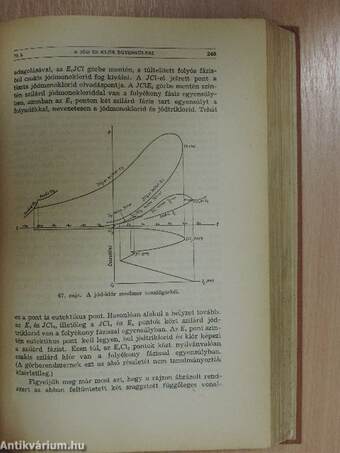
70. §. A jód és a klór egyensúlyi viszonyai 243
71. §. Kristályhidrátok oldékonysági viszonyai 246
72. §. Folyadékok kölcsönös oldékonysága 250
73. §. Kristályelegyek 252
74. §. Ötvözetek termikus analízise 257
C) Háromkomponensű (ternér) rendszerek
75. §. A háromkomponensű rendszerek ábrázolása 260
76. §. A rendszer három folyékony, nem minden arányban elegyíthető komponensből
áll 261
77. §. Olvadáspontviszonyok három komponens esetén 264
78. §. Kettőssó-képződés 265
79. §. A kettőssó-képződés térbeli ábrázolása 268
VI. FEJEZET
Kémiai mechanika
A) Kémiai reakciók sebessége (kémiai kinetika)
80. §. Alapfogalmak 269
81. §. A reakciók rendűségéről általában 271
82. §. Elsőrendű reakciók 275
83. §. Másod- és magasabbrendű reakciók 277
84. §. A reakciórend megállapítása, az egyszerű rendet zavaró hatások 281
85. §. Heterogén folyamatok I.: új fázisok keletkezésének sebessége 286
86. §. Heterogén folyamatok II.: heterogén reakciósebesség 289
B) Kémiai egyensúlyok (kémiai sztatika)
87. §. A kémiai egyensúlyokról általában; a tömeghatás törvénye 292
88. §. A térfogat (higítás) hatása a kémiai egyensúlyra. A Le Chatelier-Braun-féle elv 296
89. §. A tömeghatástörvény alkalmazásának néhány klasszikus példája. Homogén rendszerek 298
90. §. Heterogén egyensúlyok 303
Számpéldák 28-33. 307
VII. FEJEZET
A kémiai egyensúlyok termodinamikája; a termodinamika III. főtétele
91. §. A termokémiai egyenletek: Hess tétele 308
92. §. A reakcióhő változása a hőmérséklettel 311
93. §. Kémiai reakciók affinitása 312
94. §. A tömeghatás törvényének termodinamikai levezetése 314
95. §. A aktivitások 318
96. §. Az egyensúly változása a hőmérséklettel 320
97. §. Gázegyensúlyok teljes kiszámítása 322
98. §. A Nernst-Planck-féle tétel: a termodinamika III. főtétele 325
99. §. A III. főtétel alkalmazása gázreakciókra 330
100. §. Heterogén gázreakciók 332
101. §. Közelítő egyenletek az egyensúlyi állandókra 334
Számpéldák 34-43. 339
VIII. FEJEZET
Az elektrokémia alapjelenségei
102. §. Bevezetés 340
103. §. Faraday törvénye 341
104. §. Az elektrolitos vezetés és az elektrolitok molekuláris állapota 344
105. §. Az elektrolitos disszociáció létrejötte; az ionok hidratációja 347
IX. FEJEZET
Az elektrolitok vezetőképessége
106. §. Fajlagos, molekula- és ekvivalens vezetőképesség 352
107. §. Az ionok vándorlási sebessége és mozgékonysága 354
108. §. Az átviteli szám 357
109. §. A molekulavezetőképesség kiszámítása az ionok mozgékonyságából 364
110. §. Az ionok relatív mozgékonyságának a kiszámítása 366
111. §. A hidratáció hatása az ionmozgékonyságra 368
112. §. Elektrolitok diffúziója oldatban 370
113. §. A molekula- (ekvivalens) vezetőképesség és ionmozgékonyság változása a koncentrációval 373
114. §. Gyenge elektrolitok vezetőképessége; az Ostwald-féle higítási törvény 377
115. §. Az erős elektrolitok vezetőképessége 379
116. §. Az erős eletrolit-oldatok molekuláris állapota 382
117. §. A vezetőképesség változása az ionok elektrosztatikus kölcsönhatása folytán (Debye-effektus) 384
118. §. A feszültségesés hatása a vezetőképességre (Wien-féle effektus) 388
119. §. Az áram frekvenciájának hatása a vezetőképességre (frekvencia-effektus) 390
120. §. A hőmérséklet hatása a vezetőképességre 391
121. §. Az oldószer hatása a vezetőképességre (nem vizes oldatok) 393
122. §. Szilárd és megolvasztott elektrolitok vezetőképessége 394
123. §. Konduktometrikus titrálás 395
X. FEJEZET
A kémiai és elektromos energia kölcsönös átalakulásai (Galvánelemek)
124. §. A galvánelemekről általában 397
125. §. Az elektromotoros erő és reakcióhő közötti összefüggés (Gibbs-Helmholtz-féle törvény) 399
126. §. Az elektródpotenciál Nernst-féle elmélete 403
127. §. A normálpotenciál 410
128. §. Az elektródpotenciálok abszolút nullapontjának a kérdése 412
129. §. Gázelektródok 414
130. §. Keverékelektródok 417
131. §. Másodfajú elektródok 420
132. §. Koncentrációs elemek 423
133. §. A koncentrációs elemek energiaforrása 429
134. §. Diffúziós potenciálok 430
135. §. A potenciometrikus (elektrometrikus) titrálás 435
136. §. Az elektromotoros erő kiszámítása az áramtermelő folyamat egyensúlyi állandójából 436
137. §. Komplex ion- és szilárd sóképződés mint elektródfolyamat 440
138. §. Redoxpotenciálok 443
139. §. A Luther-féle szabály 450
140. §. Áramtermelésre gyakorolt használt galvánelemek 452
XI. FEJEZET
Az elektrolízis és polarizáció jelenségei
141. §. Az elektrolízis feltételei; a bomlásfeszültség 458
142. §. A határáram 463,
143. §. Túlfeszültség és passzivitás 465
144. §. Az elektrolízis legfontosabb gyakorlati alkalmazásai 469
XII. FEJEZET
Elektrolitoldatokban uralkodó egyensúlyok
145. §. Elektrolitoldatok ozmózisnyomása 480
146. §. A tömeghatás törvényének alkalmazása elektrolitoldatokra; elektrolitok aktivitási koefficiense 484
147. §. Az aktivitási koefficiens meghatározása elektromotoros erő alapján 488
148. §. Az elektrolizok disszociációs egyensúlya 491
149. §. Elektrolitok oldékonysága s annak változása idegen elektrolitok hatására 498
150. §. Nemelektrolitok oldékonyságának változása elektrolitok hatására 502
151. §. A víz disszociációja 503
152. §. A hidrolízis 507
153. §. A savak és bázisok Brönsted-féle elmélete 511
154. §. Az indikátorok 514
155. §. Puffer- (kiegyenlítő) oldatok 521
156. §. Amfotér elektrolitok 524
Számpéldák az elektrokémia köréből 44-51 528
XIII. FEJEZET
Határfelületi jelenségek Kolloid-oldatok
157. §. Bevezetés 530
158. §. Gázok és gőzök adszorpciója szilárd felületeken. Adszorpcióhő 531
159. §. Nemelektrolitok adszorpciója oldatból 537
160. §. Oldott anyagok adszorpciója az oldat felszínén; oldatok felületi feszültsége 540
161. §. Felületi feszültség és adszorpció nem elegyedő folyadékok, valamint folyadék és szilárd test határfelületén 544
162. §. Felületi hártyák szerkezete és tulajdonságai 547
163. §. Oldott elektrolitok (ionok) adszorpciója szilárd felületeken 551
164. §. A higany elektrokapillárgörbéje 555
165. §. A diffúz kettős réteg: elektrokinetikus (potenciál) 557
166. §. Elektroozmózis és áramlási potenciál 559
167. §. Elektroforézis 563
168. §. Elektrolitok befolyása a potenciálra 566
169. §. A Brown-féle mozgás; ülepedési egyensúly 569
170. §. A kolloid-oldatokról általában 574
171. §. Kolloid-oldatok stabilitása; koaguláció 577
172. §. Kolloid-aggregátumok, gélek, kocsonyák 582
Számpéldák megoldása 585
Energia-átszámítási táblázat 601
Néhány fontosabb fizikai állandó 602
Tankönyvek és monográfiák jegyzéke 603
Megvásárolható példányok
Nincs megvásárolható példány
A könyv összes megrendelhető példánya elfogyott. Ha kívánja, előjegyezheti a könyvet, és amint a könyv egy újabb példánya elérhető lesz, értesítjük.