1.118.142
kiadvánnyal nyújtjuk Magyarország legnagyobb antikvár könyv-kínálatát
Fizikai kémia I.
| Kiadó: | Egyetemi Nyomda |
|---|---|
| Kiadás helye: | Budapest |
| Kiadás éve: | |
| Kötés típusa: | Varrott papírkötés |
| Oldalszám: | 608 oldal |
| Sorozatcím: | |
| Kötetszám: | |
| Nyelv: | Magyar |
| Méret: | 25 cm x 17 cm |
| ISBN: | |
| Megjegyzés: | 147 fekete-fehér ábrával illusztrált. Második, átdolgozott kiadás. Nyomtatta Egyetemi Nyomda, Budapest. Gróh Gyula egyetemi ny. r. tanár közreműködésével írta Erdey-Grúz Tibor egyetemi c. ny. rk. tanár, Náray-Szabó István műegyetemi ny. r. tanár és Schay Géza egyetemi c. ny. rk. tanár. |
naponta értesítjük a beérkező friss
kiadványokról
naponta értesítjük a beérkező friss
kiadványokról
Előszó
Az első kiadás óta szerzett tapasztalataink arra indítottak, hogy az anyag elrendezését és feldolgozását megváltoztassuk. Az új kiadásban az I. kötetbe kerültek mindazok a fejezetek, melyek... TovábbElőszó
Az első kiadás óta szerzett tapasztalataink arra indítottak, hogy az anyag elrendezését és feldolgozását megváltoztassuk. Az új kiadásban az I. kötetbe kerültek mindazok a fejezetek, melyek nézetünk szerint minden kémikus számára fontosak, s melyekkel manapság azoknak is tisztában kell lenniök, akik nem specializálják magukat a fizikai kémiára. Ennek megfelelően az I. kötet anyagát lehetőleg egyszerűen iparkodtunk tárgyalni, úgyhogy megértéséhez a differenciál- és integrálszámítás elemein kívül magasabb matematikai ismeretek nélkülözhetők legyenek.Az első kötet elejére az anyagszerkezet és az optikai sajátságok rövid, bevezetésszerű ismertetése került. A fizikai kémia e nagy horderejű fejezeteiből e helyütt csak annyit tárgyalunk, amennyi a későbbi fejezetek megértéséhez szükséges, és amennyire minden kémikusnak szüksége van. Az atomfizikus szempontjából ez az anyagszerkezeti bevezetés ilyenformán bizonyára túl népszerűnek és ezenfelül egyes részeiben aránytalannak is fog látszani, mert a kémikus (különösen a modern organikus kémikus) számára fontosnak vélt részleteket behatóbban tárgyaltuk, mint az elvi szempontból jelentősebb, de egyelőre inkább elméleti jelentőségű fejezeteket. Részletekbe menő ismeretek helyett egyébként e téren inkább általános áttekintést igyekeztünk adni. Tehettük ezt annál is inkább, mert a II. kötetben behatóan foglalkozunk az anyagszerkezet problémáival. A II. kötetbe került a felületi jelenségek és kolloid rendszerek tárgyalása is, mert ezek értelmezése szorosan összefügg az anyagszerkezet kérdéseivel. Vissza
Tartalom
| Bevezetés | |
| Bevezetés az anyag szerkezetébe, fény és anyag kölcsönhatása | |
| Az atomok szerkezete. Az elektronburok | |
| Az elektromosság atomos szerkezete | 5 |
| Az elektron | 7 |
| A fényenergia természete; a Planck-féle kvantumelmélet és az Einstein-féle ekvivalencia-elv | 9 |
| A korpuszkuláris sugárzás hullámtermészete | 14 |
| A Rutherford-Bohr-féle atommodell | 15 |
| Az atomok kvantumszerű energiafelvételének közvetlen kísérleti igazolása: Franck és Hertz kísérlete | 18 |
| Az ionizálási energia | 20 |
| A színképekről általában | 21 |
| A vonalas színképek | 23 |
| A hidrogénatom Bohr-féle modellje | 28 |
| A magasabb rendszámú elemek színképe; a kvantumszámok | 29 |
| A Pauli-féle elv | 32 |
| A vonalas röntgenszínképek | 33 |
| A periodusos rendszer felépítése | 37 |
| Az atomok szerkezete. Az atommag | |
| Az atommag. Rendszám és atomsúly | 42 |
| Az atommagok átalakulásai I. A természetes radioaktivitás | 47 |
| Az atommagok átalakulásai II. Mesterséges atomátalakítások | 53 |
| Az atommagok átalakulásai III. A mesterséges radioaktivitás; a radioaktív indikáció | 58 |
| Az atommagok összetétele és stabilitása | 60 |
| A molekulák szerkezete; a kémiai kötés | |
| Ionvegyületek és atomvegyületek | 63 |
| Az ionvegyületek szerkezete | 64 |
| Az atomvegyületek szerkezete | 70 |
| A datív kötés; komplex vegyületek és ionok | 73 |
| A hidrogénvegyületek szerkezete | 76 |
| A molekulaspektrumok | 78 |
| A Raman-effektus | 81 |
| A fényabszorpció összefüggő közegben; Lambert és Beer törvénye | 84 |
| Dielektromos és mágneses sajátságok | |
| Dielektromos polarizáció és dielektromos állandó | 87 |
| Az eltolódási és irányítási polarizáció szétválasztása; polarizálhatóság és mólrefrakció | 91 |
| A refrakció additivitása; az atomrefrakció | 94 |
| Az irányítási polarizáció; poláris molekulák | 96 |
| A mágnesezhetőség; paramágneses, diamágneses és ferromágneses anyagok | 99 |
| Az optikai forgatóképesség | 103 |
| A termodinamika I. és II. főtétele | |
| Termodinamikai alapfogalmak | 108 |
| Az ideális gáz állapotegyenlete | 109 |
| A gáztörvény kinetikus magyarázata | 111 |
| A termodinamika I. főtétele | 113 |
| Térfogatmunka; izotermfolyamatok reverzibilis munkája | 117 |
| A hőtartalom (entalpia) | 121 |
| Fajhők (mólhők); az átalakulási hők változása a hőmérséklettel (Kircchoff tétele) | 122 |
| Termokémiai egyenletek; Hess tétele; az entrópia | 126 |
| Izoterm egyensúlyok. A maximális munka elve | 134 |
| Termodinamikai függvények | 137 |
| A termodinamikai függvények változása az állapotjelzőkkel | 140 |
| Számpéldák 1-10. | 143 |
| A gázhalmazállapot | |
| A gázhalmazállapot. Ideális és reális gázok | 144 |
| A statisztikus mechanika alapjai; Boltzmann tétele | 145 |
| A kinetikus-statisztikus elmélet és a termodinamika II. főtétele. A termodinamika statisztikus értelmezése | 148 |
| A Maxwell-féle sebességeloszlás | 153 |
| A molekulák közepes szabad úthossza. Az ütközések száma | 157 |
| Avogadro tétele, az Avogadro-Loschmid-féle szám; a molekulák átmérője | 159 |
| A gázok fajhője (mólhője) | 162 |
| Ideális gázok adiabatikus állapotváltozásai | 167 |
| Eltérések a gáztörvénytől, van der Waals egyenlete | 170 |
| Extrapolálás az ideális állapotra. Gázhőmérő és termodinamikai hőmérsékletskála | 174 |
| A gázok energiájának függése a térfogattól. A Joule-Thomsen-féle hatás | 176 |
| Számpéldák 11-14. | 180 |
| A folyékony halmazállapot | |
| A folyékony halmazállapot általános jellemzése | 182 |
| A folyadékmolekulákra ható erők | 184 |
| A folyadék és gőz egyesített van der Waals-féle egyenlete | 188 |
| A kritikus jelenségek és a van der Waals-féle egyenlet | 191 |
| A redukált állapotegyenlet. A megfelelő állapotok tétele | 193 |
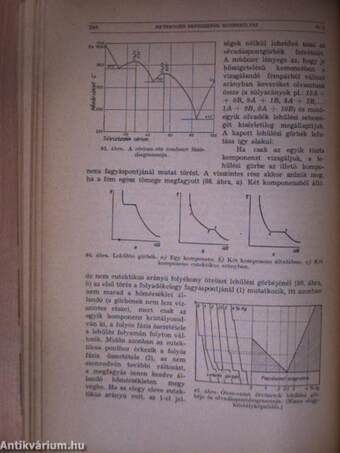
| A tenziógörbe | 195 |
| A Clapeyron-Clausius egyenlet. A párolgási hő | 197 |
| A tenziógörbe kinetikus értelmezése | 201 |
| A forráspont | 203 |
| A felületi energia. A folyadékok felületi feszültsége | 206 |
| A felületi feszültséggel összefüggő jelenségek | 208 |
| Tiszta folyadékok felületi feszültsége és annak a hőmérséklettől való függése; Eötvös szabálya | 211 |
| A szilárd halmazállapot | |
| A szilárd halmazállapot általános jellemzése | 217 |
| A kristályok, mint térrácsok | 217 |
| A kristályrácsokban működő erők | 219 |
| A szilárd testek fajhője; Dulong-Petit és Neumann-Kopp szabálya | 221 |
| A szilárd testek fajhőjének változása a hőmérséklettel | 223 |
| Az egyszerű szilárd testek jellemző frekvenciái | 227 |
| Olvadás és allotrop átalakulások | 229 |
| A szilárd testek párolgása (szublimálás) | 233 |
| Halmazállapotok és módosulatok egyensúlya; hármaspontok | 236 |
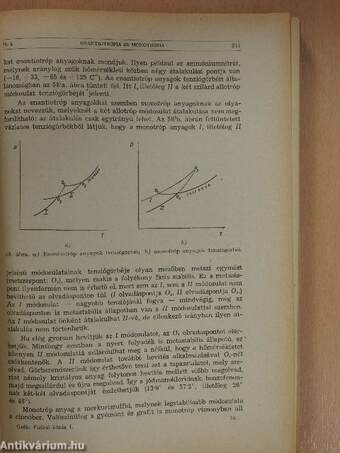
| Enantiotrópia és monotrópia | 240 |
| Az oldatok törvényei | |
| Az elegyekről és oldatokról általában | 243 |
| Az oldatok összetételének (koncentrációjának) mértékegységei | 245 |
| Parciális moláris mennyiségek | 247 |
| Gázelegyek | 249 |
| A kémiai potenciál és aktivitás | 251 |
| Folyékony oldatok tenziója. Raoult törvénye | 253 |
| Híg oldatok tenziócsökkenése | 254 |
| A híg oldatok forráspontemelkedése | 257 |
| A híg oldatok fagyáspontcsökkenése | 258 |
| Az ozmózisnyomás | 260 |
| Oldott anyagok diffuziója | 266 |
| Gázok oldhatósága folyadékban; Henry törvénye | 270 |
| Oldott anyagok megosztása két oldószer között | 272 |
| Szilárd testek oldhatósága folyadékokban. Az oldáshők | 273 |
| Eltérések az ideális viselkedéstől | 276 |
| Számpéldák 15-28. | 278 |
| Heterogén rendszerek egyensúlyi viszonyai | |
| Bevezetés. A Gibbs-féle fázistörvény | 279 |
| Kétkomponensű (binér) rendszerek | |
| Nem illékony szilárd testek oldhatósága folyadékokban | 283 |
| Vegyületképződés a komponensek között. A jód és a klór egyensúlyi viszonyai | 286 |
| Kristályhidrátok oldhatósági viszonyai | 289 |
| Kristályelegyek | 292 |
| Ötvözetek termikus analízise | 297 |
| Folyadékelegyek tenziója és oldódási viszonyai | 299 |
| Illékony folyadékok elegyének párolgása és desztillálása | 302 |
| Háromkomponensű (ternér) rendszerek | |
| A rendszer három folyékony, nem minden arányban elegyíthető komponensből áll | 307 |
| Olvadáspontviszonyok három komponens esetében | 309 |
| Kettőssó-képződés | 310 |
| A kettőssó-képződés térbeli ábrázolása | 312 |
| Kémiai egyensúlyok | |
| A tömeghatás törvénye | 315 |
| Az egyensúlyi állandó változása a hőmérséklettel és nyomással. A le Chatelier-Braun-féle elv | 318 |
| A tömeghatástörvény alkalmazásának néhány klasszikus példája. Homogén rendszerek | 322 |
| Heterogén egyensúlyok | 328 |
| Kémiai reakciók affinitása. Normálaffinitás és normálpotenciál | 331 |
| A kémiai normálpotenciálok abszolút értékei. A termodinamika III. főtétele | 335 |
| Egyensúlyok kiszámítása termikus adatokból | 341 |
| Számpéldák 29-43. | 349 |
| Az elektrokémia alapjelenségei s az elektrolitok vezetőképességei | |
| Faraday törvénye | 351 |
| Az elektrolitos disszociáció; az ionok hidratációja | 351 |
| Fajlagos, molekula- és ekvivalens-vezetőképesség | 356 |
| Az ionok vándorlási sebessége és mozgékonysága | 358 |
| Az átviteli szám | 359 |
| A molekulavezetőképesség kiszámítása az ionok mozgékonyságából | 363 |
| Az ionok relatív mozgékonyságának kiszámítása | 365 |
| A hidratáció hatása az ionmozgékonyságra | 367 |
| Elektrolitok diffuziója oldatban | 368 |
| A molekula- (ekvivalens) vezetőképesség változása a koncentrációval | 371 |
| Az erős elektrolitok vezetőképessége és molekuláris állapota | 375 |
| A feszültségesés és frekvencia hatása a vezetőképességre | 382 |
| A hőmérséklet hatása a vezetőképességre | 383 |
| Az oldószer hatása a vezetőképességre (nem vizes oldatok) | 385 |
| Szilárd és megolvasztott elektrolitok vezetőképessége | 386 |
| Vezetőképességi (konduktometrikus) titrálás | 387 |
| A kémiai és elektromos energia kölcsönös átalakulásai. (Galvánelemek) | |
| A galvánelemekről általában | 388 |
| Az e. m. e. és reakcióhő közötti összefüggés (Gibbs-Helmholtz-féle törvény) | 390 |
| Az elektródpotenciál | 393 |
| A normálpotenciál | 397 |
| Az elektródpotenciál abszolút nullapontjának a kérdése; az elektrokapillárgörbe | 400 |
| Gázelektródok | 403 |
| Keverékelektródok | 405 |
| Másodfajú elektródok | 408 |
| Koncentrációs elemek | 410 |
| Diffuziós potenciálok | 416 |
| A potenciometrikus (elektrometrikus) titrálás | 419 |
| Az e. m. e. kiszámítása az áramtermelő folyamat egyensúlyi állandójából | 420 |
| Komplex ion- és szilárd sóképződés, mint elektródfolyamat | 422 |
| Redoxi potenciálok | 425 |
| A Luther-féle szabály | 431 |
| Áramtermelésre gyakorlatilag használt galvánelemek | 432 |
| Az elektrolízis és polarizáció jelenségei | |
| Az elektrolízis feltételei; a bomlásfeszültség | 437 |
| A határáram | 441 |
| Túlfeszültség és passzivitás | 442 |
| Az elektrolízis legfontosabb gyakorlati alkalmazásai | 446 |
| Elektrolitoldatokban uralkodó egyensúlyok | |
| Elektrolitoldatok ozmózisnyomása | 453 |
| A tömeghatás törvényének alkalmazása elektrolitokra; elektrolitok aktivitási koefficiense | 456 |
| Az aktivitási koefficiens meghatározása e. m. e. alapján | 459 |
| Az elektrolitek disszociációs egyensúlyra | 461 |
| Elektrolitok oldhatósága, s annak változása idegen elektrolitok hatására | 468 |
| Nemelektrolitok oldhatóságának változása elektrolitok hatására | 471 |
| A víz disszociációja | 471 |
| A hidrolízis | 475 |
| A savak és bázisok Brönsted-féle elmélete | 479 |
| Az indikátorok | 481 |
| Kiegyenlítő (Puffer) oldatok | 487 |
| Amfoter-elektrolitok | 489 |
| Számpéldák az elektrokémia köréből 44-51. | 492 |
| Kémiai reakciók sebessége és mechanizmusa (reakciókinetika) | |
| Homogén folyamatok | |
| Alapfogalmak | 495 |
| Másodrendű reakciók | 496 |
| Elsőrendű reakciók | 498 |
| Magasabbrendű reakciók, a reakciórend megállapítása | 499 |
| Egyensúlyra vezető reakciók | 501 |
| A reakciórend eltérése a reakció-úttól | 502 |
| A reakciósebesség változása a hőmérséklettel; Arrhenius egyenlete | 506 |
| Az aktiválási energia; bimolekulás gázreakciók sebességi állandójának kiszámítása | 508 |
| Monomolekulás reakciók aktivitása | 514 |
| Atomreakciók | 519 |
| Láncreakciók | 522 |
| Robbanások | 526 |
| Homogén katalizis | 532 |
| Homogén reakciók oldatokban | 536 |
| Ionreakciók | 539 |
| Sav-bázis katalizis | 541 |
| Heterogén folyamatok | |
| Heterogén reakciók sebességét meghatározó tényezők | 544 |
| Új fázisok keletkezésének sebessége | 547 |
| Heterogén katalizis és adszorpció | 551 |
| A felületi reakciók kinetikája | 553 |
| A kontaktkatalizátorok hatásmódja | 556 |
| Fotokémia | |
| Fotokémiai alapjelenségek; primérfolyamat, kvantumhasznosítási tényező, másodlagos folyamatok | 560 |
| Néhány fotokémiai reakció mechanizmusa | 563 |
| Szenzibilizált fotokémiai reakciók | 569 |
| Kémiai lumineszcencia | 570 |
| Számpéldák megoldása | 571 |
| Energia-mértékegységek átszámítási táblázata | 586 |
| Az atomfizikában használatos energia-egységek | 587 |
| Néhány fontosabb fizikai állandó | 587 |
| Tankönyvek és monográfiák jegyzéke | 587 |
| Név- és tárgymutató | 590 |
Témakörök
- Természettudomány > Fizika > Atom- és magfizika > Általában
- Természettudomány > Fizika > Halmazállapotok
- Természettudomány > Fizika > Társtudományok > Kémia
- Természettudomány > Kémia > Általános kémia > Atomszerkezet
- Természettudomány > Kémia > Általános kémia > Halmazállapotok
- Természettudomány > Kémia > Tankönyvek > Felsőoktatási
- Természettudomány > Kémia > Társtudományok > Fizika
- Tankönyvek, jegyzetek, szöveggyűjtemények > Természettudományok > Kémia > Felsőoktatási
Megvásárolható példányok
Nincs megvásárolható példány
A könyv összes megrendelhető példánya elfogyott. Ha kívánja, előjegyezheti a könyvet, és amint a könyv egy újabb példánya elérhető lesz, értesítjük.