1.067.715
kiadvánnyal nyújtjuk Magyarország legnagyobb antikvár könyv-kínálatát

VISSZA
A TETEJÉRE
JAVASLATOKÉszre-
vételek
Elektrokémia
Eötvös Loránd Tudományegyetem Természettudományi Kar/Kézirat
| Kiadó: | Tankönyvkiadó Vállalat |
|---|---|
| Kiadás helye: | Budapest |
| Kiadás éve: | |
| Kötés típusa: | Ragasztott papírkötés |
| Oldalszám: | 226 oldal |
| Sorozatcím: | |
| Kötetszám: | |
| Nyelv: | Magyar |
| Méret: | 24 cm x 17 cm |
| ISBN: | |
| Megjegyzés: | Kézirat. Tankönyvi szám: J3-1241. Megjelent 129 példányban. 42 fekete-fehér ábrával illusztrált. |
naponta értesítjük a beérkező friss
kiadványokról
naponta értesítjük a beérkező friss
kiadványokról
Előszó
E jegyzet a vegyészhallgatók fizikai-kémiai tanulmányaihoz készült segédlet. Ezért az elektrokémia korszerű elméletének legfontosabb kérdéseit olyan terjedelemben és mélységben fogja át, ami... TovábbElőszó
E jegyzet a vegyészhallgatók fizikai-kémiai tanulmányaihoz készült segédlet. Ezért az elektrokémia korszerű elméletének legfontosabb kérdéseit olyan terjedelemben és mélységben fogja át, ami megfelel a „Fizikai Kémia" c, tárgy jelenlegi követelményeinek. Az elektrokémiát ma két nagy fejezetre szokás felosztani. Az első ezek közül, az ionos rendszerek (elektrolitoldatok és -olvadékok, valamint szilárd elektrolitok) fizikai kémiai sajátságaival foglakozik. A második pedig azokat a jelenségeket vizsgálja, amelyek az ionos rendszerek és fém, illetve félvezető határfelületén, az elektródokon lépnek fel. Az első fejezetet az utóbbi időben „ionika" a másodikat pedig „elektrodika" néven emlitik (vö. „elektronika"), A fentiek alapján az elektrokémia azokkal a jelenségekkel és folyamatokkal foglalkozik, amelyek az ionos rendszerekben, valamint az ionos rendszer/fém, illetve felvezető határán (elektródokon) lépnek fel. Az ionika a homogén, az elektrodika pedig a heterogén elektrokémiai rendszerek sajátságait, egyensúlyát, illetve a bennük fellépő nem egyensúlyi jelenségeket és folyamatokat vizsgálja. Az „Elektrokémia" első fejezete a homogén, a második pedig a heterogén elektrokémiai rendszerek törvényszerűségeit tárgyalja. A jegyzetben használatos definíciók, jelölések és helyesírás tekintetében irányadónak tekintettem Erdey-Gruz Tibor és Fodorné Csányi Piroska „A magyar kémiai elnevezés és helyesírás szabályai"-t. (Akadémiai Kiadó, Budapest, 1972), és Horányi György: „A fizikai kémiai definíciók és jelölések. III. Függelék" (Kémiai Közlemények, 46. kötet, 1976. 205) c. munkáját, valamint a Minisztertanács 8A 976. (IV.27.) számú, a mérésügyről szóló rendeletét. A vonatkozó szabályok szerint a fizikai és matematikai mennyiségek jelét mindig dölt, minden más jelet (matematikai operátorokat, egységek jelét, stb,) pedig álló betűkből kell szedni. Az alsó és felső indexek közül azokat, amelyek maguk is mennyiségek jelei, dőlt betűkből kell szedni. Minden más jelentésű index álló tipusu betűből szedendő. Az irógép tipográfiai lehetőségei korlátozottak, ezért a következőkben a dőlt szedést a szokásosnak megfelelően a betű aláhúzásával jelöljük. VisszaTartalom
Bevezetés 71. Homogén elektrokémiai rendszerek 9
14 Homogén elektrokémiai rendszerek egyensúlyai 9
1.1.1 Az ionok szolvatációja ill. hidratációja 11
1.1.2 Oldott elektrolit aktivitása, közepes aktivitás és
aktivitási tényező 13
1.1.3 Elektrolitoldatok ozmotikus sajátságai 18
1.1.4 A közepes aktivitási- és az ozmotikus tényező közötti összefüggés 21
1.1.5 Az ionok eloszlása erős elektrolitok hig oldataiban 22
1.1.6 Az aktivitási tényező kiszámítása a Debye-Hückel-féle elmélet alapján 31
1.1.7 Az erős elektrolitok aktivitási tényezője tömény oldatokban 34
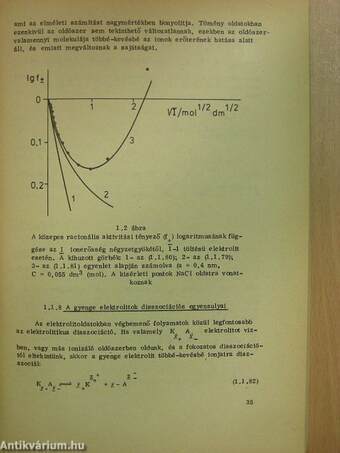
1.1.8 A gyenge elektrolitok disszociációs egyensúlyai 35
1.1.9 Kevéssé oldódó sók oldhatósági egyensúlyai 40
1.1.10 Az ionok asszociációja, ionpárok képződése 43
1.1.11 A komplex ionok egyensúlyairól 44
1.1.12 A polielektrolitok 45
1.1.13 Elektrolitok olvadékai 46
1.2 Transzportfolyamatok homogén elektrokémiai rendszereidben 47
1.2.1 A transzportfolyamatok termodinamikai tárgyalásáról 48
1.2.2 Elektrolitok transzportfolyamatainak néhány kérdése 51
1.2.3 Az elektrolitok diffúziója, a diffúziós együttható 55
1.2.3.1 A diffúziós potenciál 58
1.2.4 Az áram elektrolitikus vezetése 60
1.2.4.1 Az.átviteli szám 64
1.2.4.2 Az ionok moláris fajlagos vezetése 68
1.2.4.3 Az elektrolitoldatok vezetésének függése a koncentrációtól (Tapasztalati összefüggések) 72
1.2.5 Az erős elektrolitok vezetéséről 76
1.2.6 A gyenge elektrolitok vezetéséről 80
1.2.7 Az elektrolitikus vezetés változása nagy térerősség és frekvencia hatására 32
1.2.8 Az elektrolitikus vezetés változása a hőmérséklettel
1.2.9 A nemvizes oldatok vezetéséről 85
1.2.10 Az elektrolitolvadékok vezetése 85
1.2.11 A szilárd elektrolitok vezetése 87
2. Heterogén elektrokémiai rendszerek 90
2.1 A heterogén kémiai rendszerek egyensúlyai 91
2.1.1 Galváncellák 91
2.1.1.1 A cellareakció pontenciálja 96
2.1.1.1.1 A cellareakció potenciálja és az elektromotoros erő közötti összefüggés 99
2.1.1.1.2 A cellareakció potenciálja a formális potenciállal kifejezve 101
2.1.1.1.3 A cellareakció potenciálja és az egyensúlyi állandó 102
2.1.1.1.4 A cellareakció potenciálja és reakcióhője közötti összefüggés 103
2.1.1.2 A koncentrációs elemek 104
2.1.1.2.1 Átvitel nélküli koncentrációs elemek 108
2.1.1.2.2 A koncentrációs elemek gyakorlati felhasználásáról 109
2.1.2 Elektródok 111
2.1.2.1 Az elektródreakció potenciálja 113
2.1.2.2 Az egyensúlyi potenciál a formális potenciállal kifejezve 123
'2.1.2.3 Az elektródok osztályozása 124
2.1.2.3.1 Elsőfajú elektródok 124
2.1.2.3.2 Másodfajú elektródok 129
2.1.2.3.3 A redoxielektródok 131
2.1.2.4 Szimultán elektródreakciók egyensúlya 133
2.1.2.5 A viz elektrokémiai egyensúlyi diagramja 137
2.1.2.6 Sorozatos elektródreakciók egyensúlya 139
2.1.3 Elektrokémiai membránok 142
2.1.3.1 Membránegyensulyok és membránpotenciálok 143
2.1.3.2 Ionszelektiv elektródok 145
2.1.4 Az elektrokémiai kettős réteg 151
2.1.4.1 Az elektródokban fellépő határfelületi jelenségek termodinamikai tárgyalása 154
2.2 A heterogén elektrokémiai rendszerekben lejátszódó folyamatok 159
2.2.1 A polarizáció és a túlfeszültség 160
2.2.2 Az átlépési polarizáció 164
2.2.2.1 A csereáram 169
2.2.2.2 A túlfeszültség átlépési polarizációkor 170
2.2.3 A diffúziós polarizáció 176
2.2.3.1 A diffúziós áram 178
2.2.3.2 Az elektródpotenciál és az áramsűrűség közötti összefüggés diffúziós polarizációkor 180
2.2.3.3 A túlfeszültség és az áramsűrűség közötti összefüggés diffúziós polarizációkor 181
2.2.3.4 A folyadék mozgásának hatása a diffúziós rétegre; a forgó korongelektród 183
2.2.4 A reakció polarizáció 185
3. Az elektrokémia néhány gyakorlati vonatkozása 188
3.1 A fémek korróziója és a korrózió elleni védelem 188
3.1.1 A fémfelület inhomogenitásának hatása a fémkorrózióra 193
3.1.2 A fémek passzivitása 196
3.1.3 A korrózió elleni védelem néhány elektrokémiai módszere 198
3.2 Az elektrokémiai áramforrások 202
3.3 Az elektrolízis 211
Függelék 214
I. Az aktivitás és a vele kapcsolatos mennyiségek definíciója 214
1. A kémiai potenciál és az abszolút aktivitás 214
2. Elegyek 214
2.1 Az elegy definíciója 214
2.2 Folyékony vagy szilárd elegyben levő anyag aktivitási tényezője 214
2.3 Az anyag relativ aktivitása folyékony vagy szilárd elegyekben 215
3. Oldatok 216
3.1 Az oldat definiciója 216
3.2 Az oldott anyag aktivitási tényezője 216
3.3 Az oldott anyag relativ aktivitása az oldatban 217
II. A Gibbs-féle adszorpciós izoterma 220
III. A gyakrabban használt jelölések jegyzéke 223
Kiss László
Kiss László műveinek az Antikvarium.hu-n kapható vagy előjegyezhető listáját itt tekintheti meg: Kiss László könyvek, művekMegvásárolható példányok
Nincs megvásárolható példány
A könyv összes megrendelhető példánya elfogyott. Ha kívánja, előjegyezheti a könyvet, és amint a könyv egy újabb példánya elérhető lesz, értesítjük.