1.118.537
kiadvánnyal nyújtjuk Magyarország legnagyobb antikvár könyv-kínálatát
A rekombináns DNS
| Kiadó: | Mezőgazdasági Könyvkiadó Vállalat |
|---|---|
| Kiadás helye: | Budapest |
| Kiadás éve: | |
| Kötés típusa: | Ragasztott papírkötés |
| Oldalszám: | 207 oldal |
| Sorozatcím: | |
| Kötetszám: | |
| Nyelv: | Magyar |
| Méret: | 28 cm x 20 cm |
| ISBN: | 963-232-476-5 |
| Megjegyzés: | 177 fekete-fehér ábrával illusztrálva. |
naponta értesítjük a beérkező friss
kiadványokról
naponta értesítjük a beérkező friss
kiadványokról
Tartalom
| Előszó | 14 |
| A gének szerepe a sejtekben | 15 |
| A sejtek minden élő szervezet építőkövei | 15 |
| A sejtek pici, fejleszthető gyárak, amelyek egyidejűleg szintetizálnak több ezer különféle molekulát | 16 |
| A sejt molekulái: kis molekulák és makromolekulák | 16 |
| Az enzimek - speciális sejtkatalizátorok - meghatározzák a sejt kémiai reakcióit | 16 |
| Az enzimek működéséhez polipeptidláncuk pontos föltekeredésére van szükség | 18 |
| A molekulák nagy energiatartalmú formává való átalakítása elősegíti kémiai reakciókészségüket | 18 |
| A sejt anyagcseréjét az anyagcseretérképek szemléltetik | 18 |
| Az enzimek nem határozzák meg az aminosavsorrendet a polipeptidláncban | 19 |
| Mendel borsókeresztezési kísérletei mutatták ki először a genetikai elemek (gének) elkülönültségét | 19 |
| A kromoszómák az öröklődés hordozói a sejtben | 20 |
| Az egy gén - egy fehérje hipotézis | 22 |
| A DNS az elsődleges örökítő anyag | 24 |
| DNS kizárólag a kromoszómákban van | 24 |
| A sejtek RNS-t is tartalmaznak a DNS-en kívül | 24 |
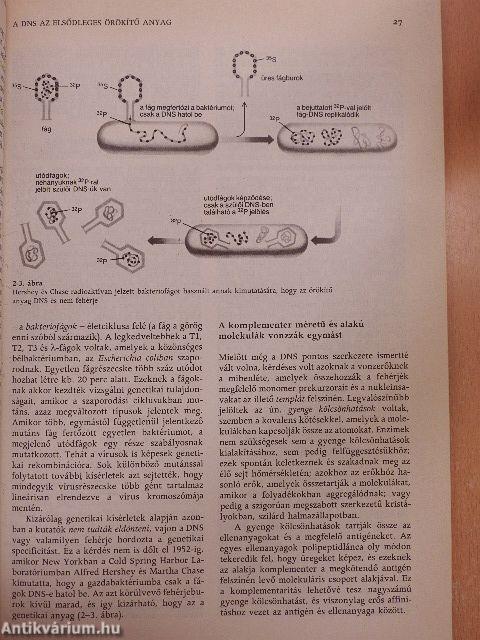
| Felfedezik az örökítő anyag biológiai vizsgálati módszerét | 26 |
| A vírusok olyan burokkal ellátott örökítő elemek, amelyek sejtről sejtre vándorolnak | 26 |
| A koplementer méretű és alakú molekulák vonzzák egymást | 27 |
| Meghatározzák a DNS átmérőjét | 28 |
| A DNS és az RNS nukleotidjai 5' - 3' foszfodiészter-kötések kapcsolják össze | 28 |
| A különböző szervezetek DNS-ének bázisösszetétele nagyon változatos | 29 |
| A DNS szerkezete szigorúan rendezett | 29 |
| A DNS alapvető egysége: két összecsavarodó polinukleotidlánc: a kettős spirál | 30 |
| A kettős spirált a bázispárok közötti H-hidak tartják össze | 30 |
| A DNS komplementaritása kulcsfeltétele az önreprodukáló képességének | 31 |
| Bizonyíték a DNS szálainak elválására a replikáció folyamán | 32 |
| A DNS-molekulák denaturálhatók és renaturálhatók | 33 |
| A G-C bázispárok nehezebben válnak el, mint a A-T bázispárok | 33 |
| A palindrómák elősegítik a fonálon belül a H-hidak kialakulását | 33 |
| 5-metil-citozin helyettesítheti a citozint a DNS-ben | 34 |
| A kromoszómák egyetlen DNS-molekulát tartalmaznak | 34 |
| A vírusok homogén DNS-molekulák forrásai | 34 |
| A lambda-fág DNS-e az E. coli kromoszómájába speciális helyen épül be | 34 |
| Az abnormális transzdukáló fágok a baktériumkromoszóma egyes részeit hordozzák | 36 |
| A plazmidok önállóan replikálódó minikromoszómák | 36 |
| A kör alakú DNS-molekulák szuperspiralizált szerkezetűek lehetnek | 37 |
| A legtöbb kettős spirál jobbmenetes, bár speciális körülmények között a DNS nukleotidszekvenciája balmentes csavarodáshoz vezet | 38 |
| A genetikai kód megfejtése | 40 |
| Aminosavcsere egy mutáns hemoglobinmolekulában | 40 |
| A finomszerkezetek genetikájának fejlődése | 40 |
| A gén és annak polipeptid terméke kolineáris | 41 |
| A DNS-től RNS szállítja az információt a proteinszintézis helyére a citoplazmába | 42 |
| Hogyan sorakoznak az RNS templáton az aminosavak? | 42 |
| Az enzimek és a templátok szerepe a nukleinsavak és fehérjék szintézisében | 43 |
| A fehérjék szintézise az N-terminális végtől a C-terminális vég irányába folyik | 43 |
| Az RNS három típusa szerepel a fehérjeszintézisben | 43 |
| Genetikai bizonyítékok igazolják, hogy a kodonok három bázisból állnak | 45 |
| Az RNS-láncok szintézise és transzkripciója is 5' - 3' irányba történik | 46 |
| A kodonok megfejtésére szintetikus mRNS-t használtak | 46 |
| 1966 júniusára teljesen megfejtették a genetikai kódot | 46 |
| A lötyögés gyakran lehetővé teszi egyetlen tRNS-fajtának, hogy többféle kodont ismerjen fel | 46 |
| Mennyire általános a genetikai kód? | 47 |
| Egy átlagos méretű gén hossza legalább 1200 bázispár | 47 |
| Szuppresszor tRNS-ek okozzák a genetikai kód hibás leovasását | 47 |
| A DNS-szekvenciában kódolt, a specifikus RNS-molekulák szintézisének kezdetét és végét jelentő jel | 49 |
| Egyre pontosabb rendszereket fejlesztenek az izolált mRNS-ek in vitro transzlációjához | 50 |
| A gének kifejeződését szabályozó genetikai elemek | 50 |
| Represszorok szabályozzák az indukált enzimek szintézisét | 51 |
| Az egymással kapcsolatban működő bakteriális gének operonba szerveződnek | 51 |
| Az RNS-szintézis startjelei a promoterek | 52 |
| A represszormolekulák konstitutív szintézise | 53 |
| A represszorokat izolálták és azonosították | 53 |
| A génátírás (transzkripció) pozitív szabályozása | 54 |
| Csillapítás (attenuation) | 54 |
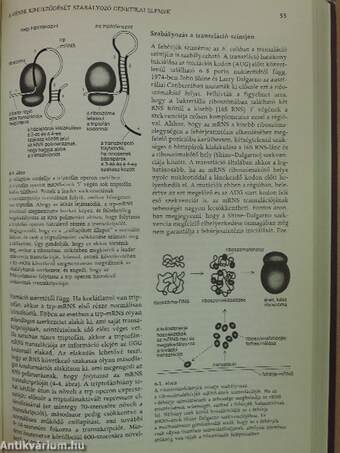
| Szabályozás a transzláció szintjén | 55 |
| Kezdeti nehézségek a magasabb rendű növények és állatok génregulációjának felderítésében | 56 |
| A karmosbéka (Xenopus) riboszomális-RNS-génjeinek tisztítása | 57 |
| Az eukariota mRNS-eknek védősapkájuk (cap) és farkuk (tail) van | 57 |
| Az eukariotákban háromféle RNS-polimeráz létezik | 57 |
| Az eukariota DNS nukleoszómákba szerveződik | 58 |
| Az emlősvírusok a magasabb rendű sejtek génexpressziójának modelljei | 58 |
| Az RNS-tumorvírusok közbeeső kettős szálú DNS segítségével szaporodnak | 59 |
| A rekombináns DNS előállításának módszerei | 60 |
| Módszerek a nukleinsavak szekvenálására | 60 |
| A restrikciós enzimek specifikus szekvenciáknál hasítják a DNS-t | 60 |
| A restrikciós térképek nagyon specifikusak | 62 |
| A restrikciós fragmentumok vezettek olyan hatékony új módszerekhez, amelyek lehetővé tették a DNS szekvenálását | 63 |
| Az oligonukleotidok kémiai szintézise | 65 |
| Az EcoRI enzimmel ragadós (kohéziós) végű fragmentumokat kapunk | 66 |
| A DNS replikációjában sok enzim vesz részt | 66 |
| Enzimekkel ragadós végeket lehet toldani a tompa végű DNS-molekulákhoz | 67 |
| Az idegen gének klónozásához kis plazmidokat használnak vektorként | 68 |
| A magasabb rendű szervezetek DNS-ének molekuláris analízisa | 69 |
| A kutatók aggodalmukat fejezik ki a szabadjára engedett génklónozás veszélyei miatt | 69 |
| Az asilomari konferencián útmutatót jevesoltak a rekombináns DNS kutatásához | 70 |
| Klónozott gének izolálása | 71 |
| Biztonsági baktériumok és plazmidvektorok kifejlesztése | 71 |
| Miért használnak drogrezisztens plazmidokat? | 71 |
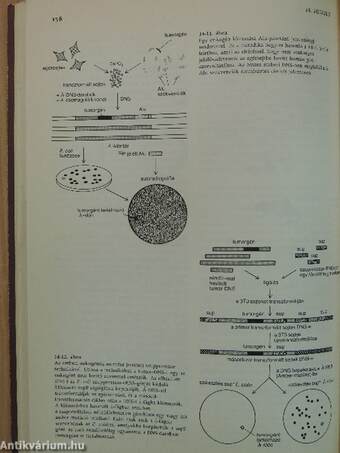
| Klónozási kísérletek | 72 |
| cDNS szintézise és klónozása | 73 |
| A speciális cDNS-klónok azonosítása | 74 |
| A lambda-fágban genomdarabok klónozhatók | 74 |
| A cosmidok teszik lehetővé nagyobb idegen eredetű DNS-darabok klónozássát | 77 |
| A kromoszómaléptetés módszere alkalmazható hosszú eukariota-DNS-fonalak analizálására | 78 |
| M13 fágban klónozva a DNS-t, gyorsabb a Sanger-féle szekvenálás | 79 |
| A Southern és a northern lenyomattechnika | 80 |
| Kisebb mennyiségben előforduló fehérjék génjeinek klónozása | 81 |
| Génkönyvtárak vizsgálata oligonukleotid-mintákkal | 83 |
| Számítógéppel illesztik egymáshoz a cDNS-osztályokat | 83 |
| A speciális eukariota cDNS izolálására felhasználhatók a megnyilvánuló tulajdonságokat kódoló vektorok is | 83 |
| A megnyilvánuló vektorok termékeinek immunológiai azonosítása | 86 |
| Az eukariota gének meglepő bonyolultsága | 87 |
| Fölfedezik a hasított (split) géneket | 87 |
| Az exon-intron határon speciális bázissorrend található | 88 |
| Az autonom hasítás fölfedezése | 90 |
| Az első emlősgén teljes szekvenciája | 90 |
| A DNS-be írt fehérjekódoknak nyitott leolvasási keretük van | 91 |
| A sejtből kiválasztódó fehérjék aminoterminális részén vezetőszekvenia (leader) található | 91 |
| Az intronok a fehérjék funkcionális domainjeit jelölhetik | 92 |
| Többféle hasítási lehetőség eredményeként ugyanarról a génről eltérő mRNS keletkezhet | 92 |
| A gének 5' és 3' végein regulátor szakaszok találhatók | 93 |
| A csoportokba tömörült géncsaládokban evolúciós maradványok lehetnek | 94 |
| Az mRNS-molekulák reverz transzkripciójával kiterjeszthetők a géncsaládok | 95 |
| Az eukariota DNS elszórt ismétlődő szakaszokat tartalmaz | 95 |
| Polipeptid prekurzorokból képződnek a fehérjehormonok | 96 |
| In vitro mutagenezis | 98 |
| Deléció (kiesés) | 98 |
| Inszerció (beépülés) | 100 |
| Szubsztitúciók (helyettesítések): a citozin dezaminálása | 100 |
| Szubsztitúciók: nukleotidanalógok beépítése | 102 |
| Szubsztitúciók: nukleotidok helytelen beépülése | 103 |
| Meghatározott szekvenciájú oligonukleotidok felhasználásával kialakítható mutánsok | 104 |
| Az ellenanyagok a csíravonalak DNS-szegmentumainak átrendeződésével jönnek létre | 106 |
| Az ellenanyagok szerkezete | 106 |
| A V és a C szakaszok kódolására külön gén szolgál | 107 |
| A V és a C gének kapcsolódásának bizonyítására mRNS-t használtak | 107 |
| Mielomasejtekből működő ellenanyaggéneket izoláltak | 107 |
| Embrionális sejtek lehetnek a még nem kapcsolódó V és C gének forrásai | 108 |
| Több kapcsoló J szakasz található a konstans C szegmentumok mellett | 108 |
| A nehéz láncot kódoló DNS három különböző részből áll | 109 |
| A VH gén DNS-szakasz eliminációjával kapcsolódik két különböző CH génhez | 109 |
| Ugyanazok a sejtek ugyanazzal a VH szegmentummal szintetizálhatják mind a mikron-, mind a delta-osztályba tartozó nehéz láncokat egy alternatív hasítási folyamat (splicing) | 110 |
| A szomatikus mutációk további forrásai az immunglobulin-variabilitásnak | 110 |
| A fő hisztokompatibilitási komplex (MHC) génjeinek és ellenanyagainak felderítése génklónozással | 111 |
| Tumorvírusok | 113 |
| A beépült (integrált) tumorvírusok klónozása | 114 |
| Az SV40 és a polioma vírus tumorfehérjéi | 114 |
| Átfedő gének kódolják az SV40 és a poliomakromatint körülvevő szerkezeti fehérjéket | 115 |
| Különböző szabályozó jelek gondoskodnak az SV40 és a polioma vírusok korai- és késői-mRNS-szintézisének iniciálásáról | 116 |
| Körülbelül 100 bázispárból álló régió tartalmazza a DNS-replikáció kezdőpontját | 117 |
| Az RNS-tumorvírusok (retrovírusok) komplex szerveződése | 117 |
| Az erősen onkogén retrovírusok specifikus onkogén szekvenciát tartalmaznak | 118 |
| A provírusokban a gének sorrendje hasonló, mint az RNS-genomban | 118 |
| Az RNS-szintézis promotere az LTR-en belül található | 119 |
| A retrovírus onkogének gyakran protein-kinázt kódolnak | 120 |
| A retrovírusok onkogénjeinek normális celluláris gének az ősei | 120 |
| Vajon a retrovírusok onkogenezise a normális celluláris gének túlműködésének vagy pedig hibás kifejeződésének a következménye? | 120 |
| A gyengén onkogén vírusok rákkeltése | 121 |
| A rák indukciójának általános elmélete | 121 |
| Mozgó gének | 122 |
| A transzpozon elmozdulása új leánytranszpozon keletkezésével jár | 123 |
| Minden szervezet tartalmazhat mozgó genetikai elemeket | 124 |
| Drosophila embriók genetikai manipulálása ugráló elemek segítségével | 124 |
| A kukorica áthelyeződő Ds elemeinek izolálása | 126 |
| Az RNS-tumorvírusok genomja a mozgó genetikai elemekből alakult volna ki? | 126 |
| Funkcionálisan két különböző transzpozonosztály létezik? | 127 |
| A kazettamodell: az ivar megváltozása élesztőben génhelyettesítéssel | 127 |
| Trypanosoma antigéntulajdonságának megváltozása génváltással | 128 |
| Antigéntulajdonság változása génátrendeződéssel a Neisseria gonorrhoeae-ben | 130 |
| DNS bejuttatása élesztősejtekbe kísérletesen szabályozott úton | 131 |
| Az élesztő szferoplasztjai felveszik a kívülről hozzáadott DNS-t | 131 |
| Az élesztő génjei működöképesek E. coliban | 132 |
| Ingázó vektorok | 132 |
| Az élesztőnek is van plazmidja | 132 |
| A transzformáció hatékonyságának növelése replikációs kezdőhelyek szaporításával | 133 |
| Az élesztő plazmidjainak stabilizálása a centromeron DNS-ével | 133 |
| Az élesztőkromoszómák végein (tolomerjein) hajtűhurkok találhatók | 134 |
| Klónozott DNS irányított bevitele élesztőkromoszómába | 135 |
| Kiemelő vektorok | 137 |
| A gén szerveződése | 138 |
| A génműködés szabályozása élesztőben | 138 |
| A növények genetikai manipulálása Agrobacterium (gyökérgolyva) plazmidokkal | 141 |
| Hagyományos növénynemesítési módszerek | 141 |
| Növényi sejttenyészetek | 141 |
| Növény regenerálása sejtkultúrából | 141 |
| A növényi protoplasztokból is teljes növény regeneráltatható | 142 |
| Hibrid növények előállítása protoplasztfúzióval | 142 |
| Génsebészet növényekkel | 143 |
| Crown gall tumorok | 143 |
| A tumort kiváltó Ti plazmid | 144 |
| Mutáns Ti plazmidok | 144 |
| A T DNS beépülése a növény kromoszómájába | 144 |
| A T DNS egy transzpozon? | 145 |
| A T DNS mendelező öröklésmenetet mutat | 145 |
| A Ti plazmidot vektorként használhatjuk | 145 |
| Növényi sejtek és protoplasztok transzformációja | 146 |
| A Ti plazmid vir szegmentuma mobilizálja a T DNS-t | 147 |
| Legyengített T DNS vektorokkal egyetlen sejtből is egész növény regeneráltatható | 147 |
| A T DNS beépítése felhasználható növényi gének izolálására | 147 |
| A Ti plazmidos manipulációk gyakorlati alkalmazása | 148 |
| Gének bevitele emlőssejtekbe | 149 |
| A Ca++ stimulálja a DNS felvételét a gerincesek sejtjeibe | 149 |
| A transzfekciós kísérletekben a timidin-kináz (tk) volt a szelekciós markerek prototípusa | 149 |
| Az egészséges sejtek transzformációjához alkalmazható dominánsan működő markerek | 150 |
| A kotranszformációt követő ligálás a sejten belül | 151 |
| A DNS mikroinjektálása az emlőssejtekbe | 152 |
| Az átvitt metilált DNS félstabil öröklődése | 152 |
| Az átvitt gének izolálása | 153 |
| A géntranszfert követő szabályozás | 155 |
| A DNS-transzfer-kísérletekkel a specifikus emberi rákgének létezése is kimutatható | 156 |
| Az emberi onkogének klónozása | 157 |
| Vírus vektorok | 160 |
| SV40 vektorok | 160 |
| SV40 virion vektorok | 160 |
| Az SV40 késői régiójának kicserélése | 161 |
| Az SV40 korai régiójának kicserélése | 161 |
| A klónozott felületi antigének analízise | 163 |
| A DNS plazmidszerű replikációja a COS sejtekben | 164 |
| Az integrálst SV40 DNS mentése (rescue) a COS sejtek fúziójával | 164 |
| Az erősítő- E(enhancer) szekvenciák fölfedezése az SV40 vektorok segítségével | 165 |
| Az egérsejtekben a szemölcs vírus DNS-e plazmid módjára szaporodik | 166 |
| Az RNS-tumorvírusokat is lehet vektorként használni | 167 |
| Idegen gének bevitele a megtermékenyített petesejtekbe | 168 |
| Az idegen gének beépülése (integrációja) a kromoszómába | 168 |
| Az idegen gének integrációja nem kromoszómaspecifikus | 169 |
| Az idegen DNS stabilan beépül az ivarsejtekbe | 169 |
| Az idegen DNS kifejeződése az egerekben | 170 |
| Az MK fúziós gén expressziója a mikroinjekció után | 170 |
| Az MK gén szövetspecifikus expressziója | 170 |
| Az utódokban az MK gén expressziója megváltozik | 171 |
| Az MGH fúziós gén funkcionális expressziója | 171 |
| A MuLV DNS beépülése | 172 |
| A fiatal embriók fertőzése MuLV-vel | 172 |
| A provírus-DNS mikroinjektálása | 173 |
| A megtermékenyített petesejtekbe bevitt gének első megnyilvánulásai | 174 |
| Az állatok klónozása | 174 |
| A genetikai betegségek és a rekombináns DNS | 176 |
| Mendeli öröklődés | 176 |
| Veleszületett anyagcsere-betegségek | 176 |
| A veleszületett anyagcsere-betegségek kezelése | 177 |
| A korai diagnózis és az abortusz | 178 |
| A veleszületett betegségek kimutatása DNS-analízissel | 178 |
| A béta-talasszémiák | 179 |
| A nonszensz és frame shift (olvasási keret eltolása) mutációk | 179 |
| A transzkripciót befolyásoló mutációk | 179 |
| Mutációk az RNS-feldolgozásban | 179 |
| Sarlósejtes anémia | 180 |
| Az alfa1-antitripszin hiányának kimutatása szintetikus oligonukleotid segítségével | 181 |
| A citrullinémia az abnormális argino-szukcinát-szintetáz mRNS-ével párhuzamosan jelentkezik | 182 |
| A mutációk kimutatása kapcsolással | 182 |
| A mutált gének felkutatása | 183 |
| Humán kromoszómák térképezése | 184 |
| A szomatikus sejtgenetika | 184 |
| Az emberi és az egérsejtek hibridjei | 184 |
| A gének helyének meghatározása a kromoszómán belül | 186 |
| A kromoszómatranszlokáció és a rák | 186 |
| In situ hibridizáció | 188 |
| Egyes kromoszómák klónozása | 188 |
| A citogenetika és a molekuláris genetika közötti szakadék áthidalása | 189 |
| A génterápia kilátásai | 189 |
| A magzati hemoglobin indukciója a talasszémiás betegekben | 190 |
| A tudomány és a rekombináns-DNS-ipar | 191 |
| A rekombináns DNS-ben rejlő üzleti lehetőség | 191 |
| Az ipari méretű génklónozás | 191 |
| A baktériumokkal termelt emberi inzulin | 192 |
| Az emberi inzulin szerkezete | 192 |
| A szintetikus inzulin-"gének" | 192 |
| A proinzulin--cDNS | 194 |
| A proinzulint kiválasztó baktériumok | 194 |
| A humán növekedési hormon klónozása | 194 |
| A növekedési hormon "génjének" előállítása | 195 |
| A metionin okozta probléma | 196 |
| A különböző típusú interferonok | 196 |
| A humán alfa-interferon hatásos kifejeződése az E. coliban | 197 |
| Az immun- (y-) interferon klónozása | 197 |
| A vírusfehérjék termelése vakminálás céljából | 198 |
| A száj- és körömfájás vírus klónozása | 198 |
| Szintetikus peptidvakcinák | 198 |
| A humán hepatitis B vírus elleni vakcinák | 199 |
| A génklónozással előállított hepatitis B antigén | 199 |
| A rekombináns DNS kutatásának eseménynaptára | 200 |
| A FÜGGELÉK | |
| Restrikciós enzimek | 202 |
| B FÜGGELÉK | |
| A rekombináns-DNS-kutatásokban felhasznált egyéb enzimek | 208 |